Nu era un fenomen al strălucirii obișnuite a mării. Monster, pop-în straturi de apă de suprafață, odihnit o toise câteva la nivelul mării, iar din aceasta a venit o forță strălucitoare, lumina inexplicabilă, care a fost menționat în rapoartele multor căpitani # 133;.
- Da, aceasta este o congestie a organismelor pur fosforescente! Unul exclamă ofițerii.
- Ești greșit, domnule, am spus ferm. "Niciodată lipsa sau lipsa nu disting o substanță luminoasă. Aceasta este o sursă de lumină electrică # 133; # 147;
Fig. 1. Obținerea energiei electrice la o centrală termică
Care dintre cititorii din copilărie nu sa scufundat în adâncurile oceanului # 132; Nautilus # 147; Electricitatea pentru căpitanul navei Nemo a fost obținută prin transformarea energiei chimice directe în electricitate într-o baterie de amalgam sodic. Acum, o parte a energiei electrice mai mari este produsă prin conversia chimică a energiei cu ajutorul reacțiilor de reducere a oxidării. Oxidantul este oxigen, aer, iar agentul de reducere (combustibil) - .. Cărbune, gaze naturale, petrol, etc. Diferența dintre materiile prime și substanțele energetice este transformată în căldură, și apoi în mișcare mecanică, și - în electricitate. Pentru a pune în aplicare acest circuit transformări necesare aranjamente complicate, voluminoase și scumpe - cazane, turbine, generatoare, și în cursul acestor transformări mai mari de energie pierdute lansat acum jumătate.
Examinarea reacției redox (prima verigă din lanțul transformărilor) sugerează dacă electronul seduce merge cu molecule antioxidante în moleculele de combustibil prin fir, și astfel să fie transformată direct în energie electrică energia de reacție nu poate fi? Primul a venit în fruntea judecătorului englez și a omului de știință Sir William Grove acum 165 de ani. Unitatea sa este reprezentata de celula electrochimică, anod este oxidat de hidrogen la catod pentru a reduce oxigen și un fir se conectează la anod la catod, curentul mers. Sir Grove îi spuse aparatul Bateria # 147 a gazului și numele # 132; celula de combustibil # 147; Acest aparat a fost obținut cu cincizeci de ani mai târziu, cu mâna ușoară a lui Ludwig Mond (de asemenea, un chimist amator, în profesia principală - un om de afaceri, unul dintre fondatorii unui imens # 132; Imperial Chemical Industries # 147;).
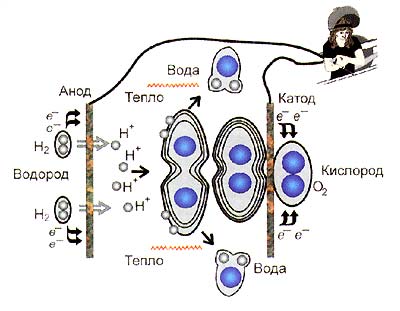
Fig. 2. Conversia chimică directă a energiei în energia câmpului electric în timpul reacției de oxidare-reducere
În timpul funcționării, celula de combustibil este aproape neîncălzită - energia eliberată în timpul reacției trece direct în electricitate. Deoarece nu există niciun element de conversie chimică intermediară a energiei în căldură în combustibil, eficiența acesteia nu este limitată de regula Carnot și, în funcție de reacția specifică, poate fi 100% și chiar mai mult! Desigur, # 132; producția de energie din nimic # 147; nu apare, dar în unele cazuri, datorită unei schimbări în reacția nu numai a energiei, ci și a reactivilor entropiei, energia câmpului electric transferă, de asemenea, o parte din energia mediului termic. Astăzi aparatul Grove este o cutie dreptunghiulară subțire (1-3 mm) care conține doi electrozi și un electrolit concentrat alcalin.
Anodul și catodul sunt pereți laterali, respectiv oxigen și hidrogen. Electrozii de contact furnizează gaz și electroliți, dispozitivul acestora fiind arătat în partea dreaptă. Transferul are loc la limita a trei faze - electrod, gaz și electrolit: electronul trece de la hidrogen la o particulă de cărbune și molecula descompune hidrogenul în protoni care reacționează cu molecule de hidroxil:-
2H2 + 4OH -> 4H20 + 4 e -.
-
O2 + 2H20 + 4 e -> 4OH -.
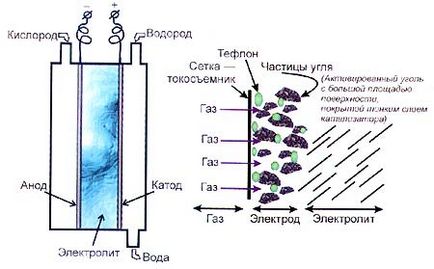
Fig. 3. Celule de combustie cu oxigen-hidrogen cu electrolit alcalin și electrod de difuzie de gaz pentru el
Aici este principala problemă: reacțiile de oxidare (combustie) merg la combustibil la temperatura camerei foarte încet - a reacționat la moleculele observabile ale amestecului, sunt necesare sute de ani. Pentru combustibil, acest element se dovedește a fi o putere specifică foarte scăzută și ar trebui să fie gigantic de măsurat.
Este necesar să se accelereze catodul și reacția anodică, pentru care poate fi utilizat fie un catalizator, fie temperatura celulei poate fi ridicată. În cazul unui element oxigen-hidrogen cu o selecție electrolitică alcalină, un catalizator bun a fost posibil; Catalizatorul este cel mai bun pentru ambii electrozi - platină, un strat din care este acoperit cu electrozi. Aceste elemente ale combustibilului au fost atât de mult succes încât acestea au fost folosite în anii '60 ai secolului trecut, pentru a furniza energia expedițiile spre Lună (dezvoltator de celule de combustibil pentru expediție lunar a fost Sir Francis T. Bacon, un descendent direct al celebrului filozof și om de stat Francis Bacon).
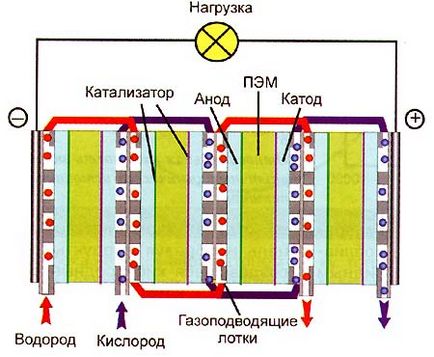
Fig. 4. Schema unei celule de combustibil pe bază de hidrogen-oxigen cu un TEM (baterie)
Acum, ca a # 132; electrolit # 147; se folosește un film - o membrană de polimer electrolitic (TEM). Se compune din molecule uriașe de acid polivalent în care o grupă acidă din restul [-S03] este atașată de partea lantului carbon al scheletului. iar protonii se mișcă liber peste polimer. Cel mai comun TEM # 151; o peliculă de poliacid poli [tetrafluoretilen] -perfluorosulfonic, sub denumirea comercială cunoscută # 132; Nafion # 147; Celulele combustibile moderne constau dintr-o peliculă subțire (de la 50 μm la 250 μm) # 132; Nafion # 147; acoperit cu două laturi de catalizator (anodice și catodice); la straturi sunt plăci de catalizator presate - colectori de curent realizați din unele (aici sunt posibile versiuni diferite) materiale poroase permeabile la gaze care conduc energia electrică. La plăci, la rândul lor, tăvile sunt presate cu canale prin care oxigenul este furnizat catodului și anodului prin hidrogen. De obicei, în modul de putere maximă, tensiunea pe celulă este de 0,5-0,6 V.
După depășirea tehnică a barierului, dezvoltatorii s-au confruntat cu o problemă economică: elementul oxigen-hidrogen s-a dovedit a fi foarte scump atât în producție, cât și în exploatare (pentru expedierea pe Lună ar putea fi neglijată). Expansivitatea elementului combustibil determină utilizarea de platină a unui electrolit polimer, de asemenea ieftin, și a complexității tehnologiei de producție.

Fig. 5. O baterie de 500 de wați de la astfel de elemente
În mod firesc, două moduri de a reduce costurile de exploatare: înlocuirea cu hidrogen pentru combustibil convențional (alcool metilic, motorină etc.) sau cerințe mai mici pentru puritatea gazului. Pentru a rezolva aceste din urmă (aparent mai ușoare) sarcinile revelator utilizat ca electrolit 100% de acid fosforic și elementul temperatură ridicată la 150-200 ° C, ceea ce a dus la succesul relativ - a devenit posibil să se aplice hidrogenului tehnic care conține 12% monoxid de carbon . În prezent, funcționează mai multe celule experimentate astfel, cu o putere cuprinsă între 5 kW și 200 kW. combustibil alcalină de celule fosfat mai ieftin, dar nu la fel de eficient (randament 40-50%), și încă prea scumpe (în jur de 500 $ / KW). Funcționarea la temperaturi mai ridicate face improprii pentru alimentarea electronice portabile, precum și nevoia de încălzire înainte de a începe limitele de aplicare pentru transport (acest lucru se aplică tuturor următoarelor elemente numite cu încălzire).
La temperaturi chiar mai mari (800-1000 ° C), celula de combustibil funcționează cu un electrolit solid de oxid. Nu există un catalizator aici, elementul constă dintr-un amestec subțire al unui strat de oxizi de ytriu și zirconiu, un electrolit solid al unui ion de oxid cu o mare volum de locuri, mobilitatea ionilor de oxigen; pe ambii electroliți laterali există grile - colectoare de curent. Pe partea laterală, combustibilul anodului reacționează cu ioni de zăbrere O-2, dând electronilor lanțului exterior și formând produse de reacție; oxigenul a creat posturile libere la catodul de-a lungul stratului electrolitic, iar electronii - la catodul de-a lungul circuitului extern, electric, creând un curent. La catod, oxigenul este atașat la electroni, iar ionii de O2 formați umple vacanțele de oxigen care s-au apropiat de catod. O astfel de baterie de combustibil are o eficiență mai mare de 50%, nu conține platină, și nu numai hidrogen și gaze naturale, dar chiar motorină, poate servi drept combustibil pentru aceasta. Problema este prezența unei zone cu temperatură ridicată, care necesită utilizarea materialelor structurale costisitoare și a agregatelor auxiliare; termenul de service al acestor elemente de combustibil nu este suficient de mare. Ca celule de combustie cu carbonați topiți, celulele de combustie cu oxid electrolitic solid vor fi cele mai convenabile pentru utilizarea în instalații staționare mari.
Așadar, în ciuda progreselor notabile din domeniul elementelor combustibile de la expediția la lună, energia lor rămâne încă prea scumpă pentru aplicații pe scară largă - este vorba de aprovizionarea cu energie a locuințelor, a întreprinderilor și a vehiculelor. Iată un exemplu simplu: cel mai bun cost al unei celule de combustibil gata de aplicare a fosfatului comercial, ținând cont de timpul de amortizare, adaugă la costul de 1 kilowatt-oră aproximativ 10 ruble. Costul hidrogenului, cu un randament de aproximativ 50%, generează un cost de energie de cel puțin 30 de ruble pe kilowatt-oră, fără a ține seama de costurile generale ale tuturor tipurilor de cheltuieli. Și prețul cu amănuntul # 132; obișnuită # 147; Electricitatea în America este mai mică de 20 cenți, adică aproximativ cinci ruble pe kilowatt-oră.
Fig. 6. Densitatea energetică relativă a diferitelor surse de nutriție chimică
Pentru hidrogen celule de combustibil a devenit un concurent al centralelor termice și nucleare, energia de care are nevoie să scadă în preț cel puțin o dată decât opt, cu mai ieftin ar dori elementul în sine, ce altceva se poate aștepta, și hidrogen - pentru care nu există nici un motiv aparent.
Din fig. 6, utilizarea acestei celule de combustibil pentru electronica portabila promite o revolutie - o perioada de crestere a functionarii continue a dispozitivelor electronice autonome de 10-20 ori. Mai mult, din toate tipurile de celule de combustibil, numai elementul TEM este potrivit pentru candidat: temperaturile rămase ale dispozitivelor mari și auxiliare (de exemplu, pompele) necesită funcționare. Este greu de imaginat că va fi posibil să se pună un acid fosforic încălzit la 200 ° C și o pompă pentru pomparea aerului într-o sursă de energie portabilă de calculator. Și cine ar vrea să-l cumpere?
Fig. 7. Densitățile energiilor gazoase de hidrogen, hidrogen lichid, baterie litiu-ion și metanol
De ce portabile toate electronica functioneaza inca pe baterii si baterii, si nu pe celule de combustibil cu TEM? Motivul este simplu: - folosesc hidrogenul în gazul lor, care are o capacitate mare de energie pe unitate de greutate, dar foarte scăzută - pe unitatea de volum, deoarece este gaz. Așa cum se poate vedea din fig. 7. Pentru a atinge aceeași densitate de volum de energie ca o baterie de litiu, trebuie să comprimăm hidrogenul până la 72 atm și luând în considerare volumul elementului și al balonului - până la 100 atm.
Nu este surprinzător faptul că sursele care furnizează electronicii portabile care consumă hidrogen nu erau foarte atractive pentru cumpărători (un exemplu al unei astfel de surse este prezentat în Figura 8).
Prin metoda # 132; condensarea # 147; ar putea ca lichefierea să devină hidrogen, oricât de necesar pentru aceasta, metoda de temperatură devine inadecvată pentru aparatele portabile. alternativă # 132; condensarea # 147; hidrogen - o aplicare diferită a combustibilului. Acesta ar trebui să aibă o densitate mare de energie, să fie ieftină și sigură (inofensiv. Nu este prea toxic, nu este un exploziv, nu este inflamabil la contactul cu aerul sau apa și altele asemenea. D.). Deoarece celula de combustibil este un sistem electrochimic, este de dorit ca și combustibilul să fie ușor solubil în apă. Mai bine că îndeplinește toate cerințele de metanol - este ieftin, se amestecă cu apă în orice proporție, ușor descompus în tratarea apei și are o de doua ori mai mare densitate de energie volumetrică chiar decât hidrogen lichid.

Fig. 8. Puterea celulelor de combustibil 50 W cu TEM pentru dispozitive portabile electronice de putere
Aparent, catodul este că unele dintre elementele ambelor sunt identice, iar designul general este similar. Diferența constă în faptul că hidrogenul este gazos în compartimentul anod al elementului și are loc reacția-
H2 - 2H + + 2e -,
-
CH3OH + H20 - CO2 + 6H + + 6e -.
Fig. 9. Compararea efectului principiului metanolului și celulelor de combustie pe bază de hidrogen cu electrolitul polimer: o manșon din schema metanolului superior reprezintă un element TEM, cel mai mic # 132; manșonul # 147; - element TEM hidrogen
Dar dacă pentru prima reacție a catalizatorului (platină) este selectată. permițându-i să accelereze și să câștige elementul cu o densitate de putere de aproximativ 0,5-0,7 watt / cm2 căutarea a doua reacție, catalizatorul este mai dificil - metanol până când densitatea celulară bună TEM puterea de probe .02-.03 W / cm 2. Astfel de valori de densitate scăzută determină puterea excesiv de mare pentru a asigura consumul de energie al unui dispozitiv tipic portabil (10-30 W). Astfel, de exemplu, că elementul combustibil, alimentarea calculatorului portabil trebuie să aibă în prezent electrozi cu o suprafață de circa 500 cm2, iar celula de combustibil va fi mai mare decât calculator. Costul și nu spun nimic - doar o singură bucată dintr-un polimer electrolit dimensiuni acoperite cu strat de catalizator 600 cm 2 va costa mai mult de 100 $ - 1.000 $ deja despre ..
Problema provine de la un mecanism electronic de transport în mai multe etape în timpul oxidării chiar și a unei molecule organice simple, cum ar fi metanolul.
Din fig. 10 arată că metanolul este adsorbit molecula de pe primul electrod, apoi, în timpul oxidării, unul după altul pierde protoni, și este transformată în grupa carbonil puternic adsorbit care nu dorește nici un desorbit sau oxidat mai departe.
Fig. 10. Mecanismul transferului electronic de etape în cursul electro-oxidării metanolice pe platină
Ca rezultat, după circa două minute după începerea oxidării platinei, electrodul este puternic otrăvit de grupările carbonilice adsorbite, iar oxidarea nu mai poate cataliza metanolul.
Încercările de a găsi un catalizator pe care atât metanolul cât și monoxidul de carbon sunt oxidate pe locurile active par să fi dus la rezolvarea problemei - catalizatorul a apărut din aliajul Pt / Ru. Ruthenium oxidează bine grupele carbonilice, dar este un catalizator slab pentru oxidarea metanolului, în timp ce platina oxidează metanolul, dar este otrăvită de monoxid de carbon. Pt / Ru-aliaj este o soluție solidă, a cărei suprafață este formată din atomi de platină și ruthenium. Grupările carbonil platină formate pe atomi migrează către atomul de ruteniu vecin, în care sunt oxidați.
Dar fabricarea de catalizator la nivel micro nu există nici un amestec perfect de atomi de atomi de platină și ruteniu ale fiecărui element sunt atrași de atomii de acest gen, adunat în grupuri, iar mecanismul funcționează numai cu privire la migrația în cadrul acestor grupuri. Este necesar, fie de a inventa un nou catalizator pentru oxidarea metanolului la monoxid de carbon insensibilă, îmbunătățesc amestecarea sau atomii de platină și ruteniu în Pt / catalizator Ru (sarbatorit recent 30-a aniversare a invenției sale). Compararea metodelor de preparare a brevetat Pt / Ru-catalizator și brevete dedicate altor catalizatori pentru pile de combustie metanol PEM, indică o idee care îmbunătățire Pt / Ru-catalizator este mai popular. Ideile principale în acest domeniu sunt cum să creați grupuri mai mici Pt / Ru pe substraturi din materiale de carbon cu o suprafață uriașă; A primit deja rezultate încurajatoare când se utilizează nanotuburi de carbon. Dar carbonul încă nanomaterialele sunt mai scumpe decât platina și ruteniul.
Vom încerca să evaluăm, să evoluăm ca apariția unei noi mărfuri pentru dezvoltarea civilizației. Înainte de o astfel de sursă întreagă stimulează puterea penetrării electronice în viața cotidiană. Abilitatea de a lucra cu un computer oriunde, fără a vă îngrijora de prezența prizelor electrice din apropiere, creșterea va determina vânzări de laptopuri și scăderea vânzărilor desktop. Obțineți o distribuție largă de cărți electronice - mini-calculatoare specializate concepute pentru a citi textul. Aceasta va conduce la trecerea unei părți a editurilor importante în producția de cărți pe suporturi CD și DVD; piața va extinde televizoarele portabile și DVD-playerele cu ecran plat etc.
Articole similare:
Un nebun în viitorul hidrogen. E. Glebova.
Pași pentru energia ultralight. S. M. Komarov.
Palladium. VV Blagutina.
Electroliți polimerici solizi. AM Timonov.
Electroliți cu oxid solid. A. Demin.
Cinci despre romane din nanocarbon. M. Yu Kornilov.
Reflecții asupra unor probleme energetice. AE Sheindlin.
Va exista o revoluție în energie? G. Nikolaev.
Frunză sintetică Lotus. A. Khachoyan.