Una dintre cele mai comune metode de accelerare a reacțiilor chimice în practica chimică este cataliza. Catalizatorul este o substanță care participă în mod repetat la etapele intermediare ale reacției, dar lasă-o chimicală neschimbată.
De exemplu, pentru reacția A2 + B2 = 2AB
participarea catalizatorului K poate fi exprimată prin ecuație
Aceste ecuații pot fi reprezentate de curbele potențiale de energie (Figura 5.2.).
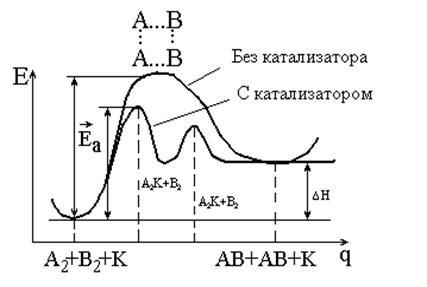
Fig. 5.2. Schema energetică a reacției
cu catalizator și fără catalizator
Figura 5.2 arată că:
1) catalizatorul reduce energia de activare prin schimbarea mecanismului de reacție - trece prin noi etape, fiecare dintre acestea caracterizată printr-o energie de activare redusă;
2) catalizatorul nu modifică reacția DN (precum și DG, DU și DS);
3) dacă reacția catalizată este reversibilă, catalizatorul nu afectează echilibrul, nu modifică constanta de echilibru și concentrațiile de echilibru ale componentelor sistemului. De asemenea, accelerează atât reacțiile directe cât și cele inverse, accelerând astfel timpul pentru a atinge echilibrul.
Evident, în prezența catalizatorului, energia de activare a reacției scade cu o valoare a DEk. Deoarece în expresia pentru constanta vitezei de reacție (Ecuația 5.10), energia de activare intră în exponent negativ, atunci chiar și o mică scădere în Ea determină o creștere foarte mare a ratei de reacție :.
Efectul catalizatorului asupra reducerii Ea poate fi demonstrat prin exemplul reacției de descompunere a iodurii de hidrogen:
Astfel, pentru reacția luată în considerare, o scădere a energiei
activare la 63 kJ, adică De 1,5 ori, corespunde unei creșteri a ratei de reacție la 500 K mai mult de 10 6 ori.
Trebuie remarcat faptul că factorul pre-exponențial al reacției catalitice k0 1 nu este egal cu k0 și este de obicei mult mai mic, dar scăderea corespunzătoare a vitezei nu compensează creșterea acestuia datorită lui Ea.
Exemplul 5. Energia de activare a unei anumite reacții în absența unui catalizator este 75,24 kJ / mol, iar cu catalizatorul, 50,14 kJ / mol. Rata de reacție crește rapid în prezența catalizatorului dacă reacția se desfășoară la 25 ° C, iar factorul pre-exponențial în prezența catalizatorului scade cu un factor de 10.
Soluția. Indicăm energia de activare a reacției fără un catalizator prin Ea. și în prezența unui catalizator, prin Ea1; vom denumi constantele ratei corespunzătoare cu k și k 1. Folosind ecuația Arrhenius (5.9) (vezi Secțiunea 5.3) și luând k0 1 / k0 = 10, găsim:
Astfel, o scădere a energiei de activare a catalizatorului cu 25,1 kJ a dus la o creștere a ratei de reacție de 2500 de ori, în ciuda unei scăderi de 10 ori a factorului pre-exponențial.
Reacțiile catalitice sunt clasificate pe tipuri de catalizatori și pe tipul de reacții. Astfel, catalizatoarele sunt împărțite în catalizatori și reactivi omogeni (catalizatori și reactanți formează o fază) și heterogeni (catalizatori și reactivi în diferite faze, există o limită de fază între catalizator și reactivi).
Un exemplu de cataliză omogenă poate fi oxidarea CO la CO2 cu oxigen în prezența NO2 (catalizator). Mecanismul de cataliză poate fi reprezentat de următoarele reacții:
iar catalizatorul (NO2) participă din nou la prima reacție.
În mod similar, reacția de oxidare a S02 în S03 poate fi catalizată; o reacție similară este utilizată pentru producerea acidului sulfuric într-un mod "azotic".
Un exemplu de cataliză eterogenă este producerea de SO3 din S02 în prezența Pt sau V205:
Această reacție este, de asemenea, utilizată în producția de acid sulfuric (metoda "contact").
Catalizatorul heterogen (fier) este, de asemenea, utilizat în producția de amoniac din azot și hidrogen și în multe alte procese.
Eficacitatea catalizatorilor heterogeni este de obicei mult mai mare decât cea a catalizatorilor omogeni. Rata reacțiilor catalitice în cazul unui catalizator omogen depinde de concentrația sa și, în cazul unui catalizator eterogen, pe suprafața sa specifică (adică, dispersia), cu cât este mai mare, cu atât viteza este mai mare. Aceasta din urmă se datorează faptului că reacția catalitică se desfășoară pe suprafața catalizatorului și include etapele de adsorbție (aderență) a moleculelor reactivilor de pe suprafață; la sfârșitul reacției, produsele sale sunt desorbite. Pentru a mări suprafața catalizatorilor, ele sunt zdrobite sau obținute prin metode speciale, în care se formează pulberi foarte fine.
Exemplele de mai sus sunt simultan exemple de cataliză de oxidare-reducere. În acest caz, metalele de tranziție sau compușii lor (Mn3 +, Pt, Au, Ag, Fe, Ni, Fe2O3 etc.) sunt de obicei calitatea catalizatorilor.
În cataliza acidă bazică, rolul catalizatorului se realizează prin H +. OH - și alte particule similare - purtători de aciditate și bazicitate. Astfel, reacția de hidroliză
este accelerată de aproximativ 300 de ori prin adăugarea oricărui aciziu puternic: HCI, HBr sau HNO3.
O mare importanță a catalizei este în sistemele biologice. În acest caz, catalizatorul se numește o enzimă. Eficacitatea acțiunii multor enzime este mult mai mare decât cea a catalizatorilor convenționali. De exemplu, pentru reacția de legare a azotului la amoniac
În industrie, se utilizează un catalizator eterogen sub formă de fier burete cu aditivi de oxizi și sulfați de metale.
În acest caz, reacția este efectuată la T »700 K și P» 30 MPa. Aceeași sinteză are loc în nodulii plantelor leguminoase sub acțiunea enzimelor la T și P obișnuite
Sistemele catalitice nu sunt indiferente față de impurități și aditivi. Unele dintre ele cresc eficiența catalizei, de exemplu, în exemplul de mai sus al catalizei sintezei amoniacului cu fier. Astfel de aditivi în catalizator sunt numiți promotori (oxizi de potasiu și aluminiu în fier). Unele impurități, dimpotrivă, suprimă reacția catalitică ("otravă" catalizatorul), acestea sunt otrăvuri catalitice. De exemplu, sinteza S03 pe un catalizator Pt este foarte sensibilă la impuritățile care conțin sulfuri de sulf; sulful otrăvește suprafața catalizatorului de platină. Dimpotrivă, un catalizator bazat pe V2O5 este insensibil la astfel de impurități; Onoarea de a dezvolta un catalizator pe bază de oxid de vanadiu aparține omului de știință rus G.K. Boreskov.