Informații generale privind structura atomului de azot
Azotul este al șaptelea element al tabelului periodic. Se referă la metale nemetalice. Se află în cea de-a doua perioadă a grupului V din grupa A a subgrupului.
Numărul secvenței este 7. Încărcarea nucleului este egală cu +7. Greutatea atomică este de 14.007 amu. În natură, există două izotopi de azot: 14 N - 99,635% și 15 N - 0,365% (în paranteze indică procentajul lor).
Structura electronică a atomului de azot
Atomul de azot are două cochilii, ca toate elementele situate în a doua perioadă. Numărul de grup -V - indică faptul că există 5 electroni de valență la nivelul electronic extern al atomului de azot.
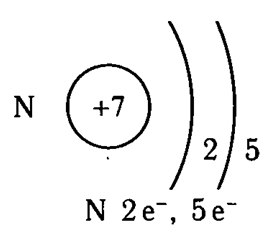
Fig. 1. Structura schematică a atomului de azot.
Configurația electronică a stării solului este scrisă după cum urmează:
Azotul este un element al familiei p. Schema de energie pentru electronii de valență în stare neașteptată este după cum urmează:
Nu există stare excitată. Prin numărul de electroni nepartiți, putem spune că azotul din compuși prezintă valența III. Cu toate acestea, valența este de asemenea determinată de numărul grupului (V), prin urmare azotul poate prezenta două valențe - III și V.
Fig. 2. Reprezentarea spațială a structurii atomului de azot.