Astăzi publicăm un articol despre cum să construim o baterie de gaz prin noi înșine. Cine dintre voi într-o zi, în viitor, va fi energie și, probabil, se vor dezvolta cele mai noi surse de energie pentru vehicule electrice - care a fost atunci, și vă va ajuta cu experiența dobândită în timpul construcției bateriilor, a căror divulgare, am început să publice în revista.
În orice acumulator există plăci pozitive și negative cu o substanță activă formată din metale diferite. Ca mediu conductor, se folosesc de obicei soluții apoase de acizi sau alcalii. O astfel de soluție este numită un electrolit. Când plăcile se scufundă în electrolit, va începe să apară o reacție chimică și dacă acestea sunt închise printr-un dispozitiv de măsurare, descoperim că un curent extern trece prin circuitul extern.
În timpul funcționării bateriei, precum și atunci când o încărcați, puteți observa că bulele de gaz se evidențiază pe plăcuțe. Gazele, de regulă, nu participă la reacții și nu exercită un rol auxiliar în procesele electrochimice, astfel încât, în cazul acumulatorilor obișnuiți, diferența de potențial este determinată numai de proprietățile metalelor din care sunt compuse plăcile. Dar, se pare, gaze diferite au, de asemenea, un potențial electrochimic foarte clar. Prin urmare, această capacitate poate fi utilizată pentru a produce o baterie în care două gaze diferite vor juca rolul substanței active.
Bateria cu gaz a fost inventată în 1955 de inginerul sovietic A. Presnyakov.
Un avantaj important al bateriei cu gaz este simplitatea aparatului și rentabilitatea ridicată. Pentru producția sa nu sunt necesare metale neferoase și materiale costisitoare. Performanța unei baterii cu gaz este, de asemenea, foarte ridicată. baterie de gaz pot fi stocate pentru perioade lungi de timp într-un spectacol sa încărcat sau neîncărcat, și nu a afectat. Permite un curent de încărcare mare, ceea ce reduce timpul de încărcare. Chiar și plăcile prelungite de închidere între un gaz inofensiv pentru baterie, deoarece, în acest caz, deși este descărcat, dar fără procese ireversibile în materialul activ, ca și în alte tipuri de baterii.
Acumulatorii de gaz sunt surse constructive de curent. Crearea lor a devenit posibilă numai după descoperirea unor substanțe capabile să absoarbă gaze în cantități mari și să le păstreze în sine. Astfel de substanțe se numesc adsorbanți. Unul dintre cei mai buni adsorbanți este cărbunele activate. Absorbind gazele, el însuși nu participă la reacții chimice.
Tabelul de mai jos arată câte gaze diferite pot fi absorbite de un gram de carbon activat la 15 ° C și presiune normală. Veți observa imediat regularitatea: gazul este absorbit cu atât mai bine, cu atât este mai mare temperatura critică, adică cu cât este mai ușor să se lichefieze.
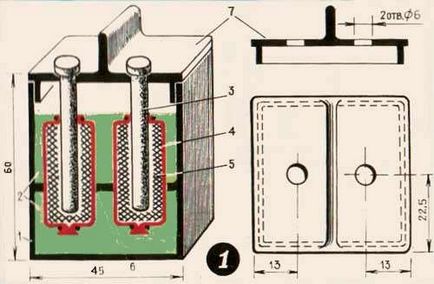
Structura acumulator de gaz improvizat ilustrat în Figura 1. Recipientul 1 este turnat un electrolit 2. Electrolitul doi electrozi sunt omise, și care constau din tija 3 și sacul 4 cu pungi de cărbune activat 5. Protejează împotriva partitie deplasare 6 care este confecționat din orice material izolator electric. Containerul este închis cu un capac 7.
Deoarece capacitatea bateriei cu gaz, de exemplu, cutii de condimente pot fi utilizate cu succes - acestea sunt vândute în magazinele de hardware. Poți să iei și borcane de sticlă, dar trebuie să fie acoperite din exterior cu lac de asfalt, astfel încât lumina să nu penetreze înăuntru, altfel va ajuta la descărcarea bateriei.
Pungi fabricate dintr-un vechi nailon de stocare strâns tricotate. Cusătura poate fi cusută cu un fir capron cu un fier de lipit pe un miez din lemn rotund.
Un capăt al sacului cravată strâns un fir de nailon, și un al doilea, deschis, introduceți tija de carbon din baterii lanterna, sfârșitul vieții. Umpleți pungile cu carbon activ, sigilându-l bine. Îndoiți marginile sacului, leagă-le cu un fir capron în jurul tijei. Acum trebuie să înfășeri punga. Cu cât se fac mai multe întoarceri, cu atât este mai bine contactul pudrei de cărbune cu miezul, cu atât rezistența internă a bateriei este mai mică, cu atât funcționează mai bine.
Electrozii trebuie să fie fixați în capac, iar bornele până la capetele de ieșire ale tijei trebuie atașate. Cel mai bine este să folosiți cărbune medical, care este vândut în farmacii, sau cărbune din măștile de gaze respinse. În cazurile extreme, cărbunele pot fi ușor pregătite de dumneavoastră. Pentru a face acest lucru, să ia 5-10 tije mm diametru, 100 mm lungime (de orice tip de lemn), conectați-le într-un fir de fascicul, așezați staniu poate și umple cu nisip de râu uscat. Puneți borcanul în aragaz pe cărbuni fierbinți sau pe o sobă de gaz și ardeți până când băncile nu mai emit gaze.
Lăsați să se răcească nisipul, apoi îndepărtați drosselurile incrustate - acestea pot fi folosite în materie. Pentru a obține de la acumulator capacitatea de 1 ampere-oră va necesita 50-90 grame de carbon activat.
Pentru electrolitul este mai bine să ia apă distilată, care pot fi achiziționate într-o farmacie, sau cel puțin din puțuri sau robinet anterior prin fierberea acestuia timp de aproximativ o oră și se răcește. Pentru fiecare pahar de apă, se toarnă 1-1,5 linguriță de sare de masă Extra. Umpleți vasul cu electrolit și acoperiți cu electrozi, asigurându-vă că electrozii sunt complet imersați în electrolit.
Cea mai simplă baterie de gaz este gata, acum trebuie doar să fie încărcată. Pentru aceasta, este necesar să conectați electrozii la o sursă de curent continuu cu o tensiune de 4,5 V. Marcați o vopsea strălucitoare cu un electrod pozitiv, punând o marcă + pe capac. Un electrod negativ poate fi omis. Când reîncărcați bateria, asigurați-vă că respectați polaritatea electrozilor. Completați încărcarea atunci când tensiunea pe electrozii bateriei este de 2,2-2,5 volți.
Când bateria funcționează în mod constant, electrolitul trebuie schimbat cel puțin o dată pe săptămână. (Rețineți că o înlocuire atât de frecventă este necesară numai pentru electroliți, care se bazează pe sare de masă.)
Bateria funcționează astfel. În timpul încărcării, atunci când electrozii sunt conectați la tensiune, electrolitul se descompune în hidrogen și clor. Electrodul atașat la firul negativ va absorbi hidrogenul și la clorul pozitiv. Aceasta creează o diferență de potențial. O reacție chimică poate fi descrisă prin ecuația:
Ca electrolit în acumulatorii de gaz, pot fi utilizate soluții de diferite săruri, acizi și alcalii. Selectarea electrolitului, este posibil să se efectueze electroliza pe acele sau alte gaze și să se primească diferite forțe și capacități electromotoare ale acumulatorului. Astfel, la electroliza unei soluții slabe de acid sulfuric, obținem o vapori de hidrogen-oxigen. O soluție de bicarbonat de sodiu va da un abur de hidrogen - dioxid de carbon. În general, alegerea electrolitului deschide posibilități foarte largi de experimentare.
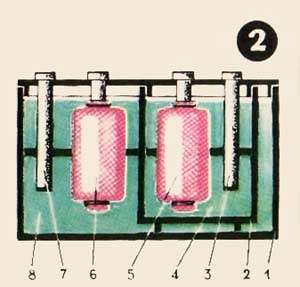
Figura 2 prezintă o diagramă a unui acumulator de gaze în care se utilizează abur, clor-dioxid de sulf. (Dacă vă întoarceți la masa noastră, veți vedea că aceste gaze sunt absorbite mai bine decât altele de către cărbune.) Performanțele destul de înalte justifică complicația constructivă.
Bateria constă dintr-un vas principal 1, vasul auxiliar 2, electrod de cărbune auxiliar 3 și 7, un electrolit 4 care umple vasul auxiliar electrozii principali de carbon 5 și 6, electrolit 8. Baterie Dimensiuni de pick, pe baza dimensiunilor electrozilor de carbon cu baterii pentru lanternă.
Într-o astfel de baterie, dioxidul de sulf este un purtător de potențial negativ și clor, pozitiv. Electrolitul vasului principal este o soluție de sare obișnuită, electrolitul auxiliar este o soluție de sulfură de sodiu (alte denumiri sunt sulfura de sodiu, monosulfura de sodiu).
Așa cum am spus, vasul auxiliar ar trebui să fie semipermeabil, adică să lase gazele să treacă, dar să nu lase sărurile dizolvate în treapta de electrolit. O astfel de navă poate fi achiziționată la un magazin de produse chimice sau fabricată de dvs. înșivă, iar autocontrolul nu poate fi inferior celui industrial. Materiale: argilă albă, care este utilizat pentru lapte de var, ferocianură de potasiu (alte nume: ferocianură de potasiu, sare de ferocianura; nu trebuie confundate cu fericianură de potasiu - fericianură de potasiu), sulfat de cupru. Atât clorura ferică cât și sulfatul de potasiu pot fi cumpărate în departamentele de materiale fotograficice.
Frământați lutul în stare plastică și formați un pahar din acesta. Pereții paharului trebuie să fie cât mai subțiri. Uscați geamul și apoi ardeți cărbuni fierbinți până când hârtia plasată în geam este cărbită, dar nu este spălată. Mai bine dacă prăjirea este efectuată într-un cuptor de mufe, care se află în sălile de clasă ale chimiei. După răcire, umpleți paharul cu o soluție saturată de clorură feroasă și lăsați-l până când pereții exteriori ai acestuia devin umedi. Se toarnă soluția (se poate reutiliza), se lasă să se usuce, apoi se coboară timp de 4-5 ore într-o soluție saturată de sulfat de cupru. Soluțiile trebuie preparate pe bază de distilată, zăpadă sau apă de ploaie. Este necesar să luăm o asemenea cantitate de sare, că, în mod necesar, acolo era o odihnă insolubilă - și va exista o soluție saturată.
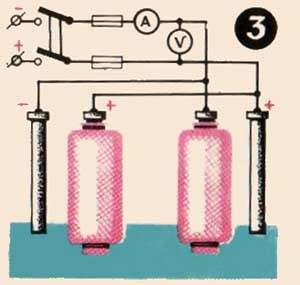
Figura 3 prezintă schema de conectare pentru încărcarea unei baterii cu patru electrozi.
Schema încărcătorului este prezentat în Figura 4. potențiometrul R3 curent reglat bază tranzistor, prin valoarea tensiunii poate fi modificată la ieșirea de la 0,5 la 15 V și amperajul în termen de 0-5 A. Transformatorul de putere poate ipolzovat de la vechiul radio sau TV . La ieșirea sa ar trebui să existe o tensiune de 20 V la un curent de 6 A.
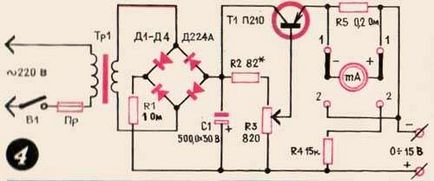
Diodurile și un tranzistor trebuie montate pe chiuvete sau radiatoare. Valorile șuntului R5 și rezistența suplimentară R4 pot varia în funcție de sensibilitatea și rezistența internă a dispozitivului utilizat pentru a măsura mărimea curentului și a tensiunii.
Încărcătorul nu necesită o reglare specială și este gata de funcționare când este asamblat corect.