Informații generale despre valența cobaltului
Cobaltul este un element al celei de a patra perioade a grupului VIII din subgrupul secundar (B) al tabelului periodic. Metal. Desemnarea - Co Numărul de serie este de 27.
Sub forma unei substanțe simple, cobaltul este un metal alb strălucitor, cu o nuanță gălbuie. În comparație cu fierul, cobaltul este mai greu și mai fragil. Densitate 8,90 g / cm3. Punct de topire 1492 ° C, punct de fierbere 2960 ° C.
Cobalt are două modificări. Până la 430 o C, α-cobaltul este stabil cu o latură hexagonală închisă, peste 430 o C fiind β-cobalt cu zăbrele cubice centrate pe față.
Valența cobaltului în compuși
Cobaltul este elementul douăzeci și șapte al Mesei Periodice. Universitatea Mendeleev. El se află în cea de-a patra perioadă din grupul VIIIB. Nucleul atomului de cobalt conține 27 protoni și 32 de neutroni f (numărul de masă este de 59). Există patru niveluri de energie în atomul de cobalt, pe care sunt localizate 27 de electroni (Figura 1).
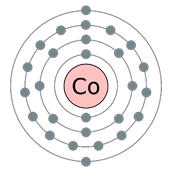
Fig. 1. Structura atomului de cobalt.
Formula electronică a atomului de cobalt în starea de bază are următoarea formă:
Și diagrama energiei (construită doar pentru electronii de nivelul energiei externe, care se numește valență într-un alt mod):
Prezența a trei electroni nepartiți indică faptul că cobaltul prezintă compușii săi valența III (Co2O3, Co (OH) 3, CoCI3, Co2S3). Se știe că cobaltul este, de asemenea, caracterizat prin valența II (CoO, Co (OH) 2, CoCI2, CoBr2).
Exemple de rezolvare a problemelor
Cobaltul cu o masă de 2,95 g a fost dizolvat în acid clorhidric, s-a format o sare de cobalt (II), prin soluția rezultată s-a trecut hidrogen sulfurat. Se determină masa precipitatului format.
Redactăm ecuațiile de reacție, care sunt menționate în starea problemei:
Să găsim cantitatea de material cobalt care a reacționat (masa molară - 59 g / mol):
n (Co) = m (Co) / M (Co);
n (Co) = 2,95 / 59 = 0,044 mol.
Conform ecuației (1), n (Co). n (CoCl2) = 1: 1, prin urmare, n (Co) = n (CoCI2) = 0,044 mol. Apoi, cantitatea de mol de sulfură de cobalt (II) (precipitat) va fi de asemenea 0,044 moli, deoarece n (CoCI2). n (CoS) = 1: 1. Masa sulfurii de cobalt (II) este (masa molară - 91 g / mol):
m (CoS) = n (CoS) x M (CoS);
m (CoS) = 0,044 x 91 = 4,004 g.
Greutatea sulfurii de cobalt (II) este de 4,004 g.
Potențialul electrodului standard al nichelului este mai mare decât cel al cobaltului (E o Co 2+ / Co o = -0,27 V, E o Ni 2+ / Ni 0 = -0,25 V). Acest raport se va schimba dacă vom măsura potențialul de nichel într-o soluție a ionilor săi cu o concentrație de 0,001 mol / dm 3. și potențialul de cobalt într-o soluție cu o concentrație de 0,1 mol / dm3.
Vom determina potențialul electrodului de cobalt și nichel în condițiile date folosind ecuația Nernst:
E 'Ni2 + / Ni0 = -0,25 + (0,059 / 2) xlg10-3;
E 'Co2 + / Coo = -0,27 + (0,059 / 2) xlg10-1;