Principalele date experimentale au început să apară la începutul secolului XX. Apa lichidă, purificată și atent iradiat într-un mediu în care gazul nu poate fi îndepărtat din soluție, similară în proprietățile sale, vaporii de apă, adică. E. Nu se descompune în mod apreciabil prin acțiunea radiației cu radiații LET scăzut, ca razele X. Pe de altă parte, apa se descompune în hidrogen și oxigen sub acțiunea radiației cu LET mare, de exemplu # 945; - particule. Radiation Chimie de specialitate în SUA deja confirmat în 1948 că descompunerea apei prin acțiunea low-LET crește semnificativ radiații în prezența impurităților în apă. Oxigenul este doar o astfel de impuritate: aceasta este cauzată de formarea apei sub influența unei radiații LET și peroxid de hidrogen scăzut. Peroxidul de hidrogen, în sine, intensifică, de asemenea, radioliza atunci când este expus radiației cu o LET mică, în timp ce hidrogenul suprimă radioliza. Prin urmare, în cazul în care apa este iradiat „în condițiile în care hidrogenul poate fi îndepărtat din acesta prin contactul cu un volum mare sau evacuat la fierbere (de exemplu, în fierbere, reactor tip apă sub presiune), apoi descompunerea este intensificată.
Interacțiunea dintre radiația ionizantă și materie (inclusiv apa) este de obicei împărțită în trei etape: fizice, fizico-chimice și chimice.
În stadiul fizic, apar numai procese electronice. Conform tabelului, constantele ratei de captare a electronilor în gaze la temperatura camerei, în funcție de momentul de timp
10 -16 s după trecerea particulelor ionizate în apă, ca urmare a proceselor de excitație și de ionizare excitat format (H2O *) și superexcited (** H2O) de molecule de apă, ionii H2O +. ionii de H20 excitați. electronii secundari. H2O ionic + are o energie medie de 8 eV. Uneori
10 -15 s gaura "uscată" H2O + poate migra de-a lungul mecanismului de rezonanță. Timpul pentru o astfel de migrare este de 10 -15 s. Este posibilă și migrarea excitației. În această perioadă, electronii secundari își pierd energia până la o valoare egală cu energia de prag a excitației electronice a H2O în faza lichidă. În acest caz apar electroni fără excitație. Energia lor <7,4 эВ.
În această etapă, există și o excitație colectivă (volum delocalizat), numită plasmonă. Energia sa este de 21,4 eV, iar dimensiunea liniară a regiunii acoperite de aceasta (față de axa liniei) este de 29 nm. Stimularea plasmonică este foarte rapidă (pentru
10 -16 s) este localizat cu formarea ionilor predominant de H2O +.
Stadiul fizico-chimic al radiolizării apei începe aproximativ între 10 și 14 s. În acest stadiu, un rol important îl joacă procesele care implică molecule, ca rezultat al echilibrului termic în sistem.
Timpul oscilației unei molecule H2O este
10 -14 s. Prin urmare, pentru timpul indicat să apară suprastimulare de disociere și molecule excitate molecule suprastimulări autoionization și reacția ion-molecula cu H2O + H2O La finalul etapei fizico-chimic (m. E. momentul de timp
Radicali OH și ioni de H30 +. pe de o parte, și electronii hidratați, pe de altă parte, au o distribuție inițială inegală, iar e-aq sunt distribuite mult mai difuz decât OH și H3O +. Schema distribuției inițiale a produselor primare de radioliză a apei este prezentată în figură:
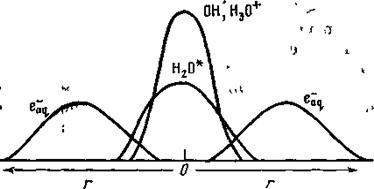
În stadiul chimic, particulele de mai sus difuzează de la locurile formării lor
Intermediari în radioliza apei. Radioliza apei este considerată în cadrul proceselor fizice care au loc în ea sub acțiunea radiației. Consecințele acestor procese fizice nu pot fi anticipate pe baza unor legi generale, însă munca experimentală atentă face posibilă obținerea unei imagini adecvate a radiolizelor. Principala observație experimentală este că pentru un număr mare de soluții de diferiți compuși în apă substanța dizolvată se modifică sub acțiunea radiației, iar pentru multe substanțe dizolvate această modificare este proporțională cu doza absorbită și nu depinde în mod semnificativ de concentrația substanței. De exemplu, în fascicule de raze X iradiate de soluții apoase de ferosulfat se formează ioni de Fe 3+. iar numărul total al acestora la o doză dată nu depinde de concentrația de Fe2 +. Acest lucru indică faptul că radiația acționează asupra substanței dizolvate nu direct, ci indirect, prin ceva care se formează din apă. Această presupunere este, desigur, foarte plauzibilă, deoarece radiația afectează în principal partea excesivă a sistemului, adică apa.
Rezultă dintr-un număr mare de experimente că procesul radiațiilor chimice în soluții apoase este, în esență, redox. Acest lucru devine clar dacă presupunem că prin iradierea în apă se formează atomi de H (particule reducătoare) și radicali OH (particule oxidante). Atomii H și radicalii OH se formează în timpul disocierii moleculelor de apă excitate sau în timpul ionizării. Astfel, dacă efectul radiațiilor asupra apei este formarea atomilor de H și radicali OH capabili să reacționeze cu substanțele dizolvate, se poate preconiza că concentrațiile adecvate minore vor fi suficiente pentru a captura toți atomii și radicali. Prin urmare, atomii de H nu pot reacționa unul cu celălalt și dau hidrogen molecular, iar radicalii OH sunt peroxid de hidrogen, respectiv. Cu toate acestea, în unele soluții apoase, de exemplu, se diluează apă oxigenată și soluții oxigenați în sulfat de fier, hidrogen se formează atunci când este iradiat cu o putere semnificativă, indiferent de concentrația solutului. De asemenea, se formează o cantitate echivalentă de peroxid de hidrogen. Acest lucru este de înțeles dacă se presupune că, cu excepția atomilor de H și radicali OH când iradiate în apă sunt formate ca produse primare de hidrogen molecular și peroxid de hidrogen.
Până în prezent, sa demonstrat în mod convingător că efectele chimice ale apei iradiate și ale soluțiilor apoase diluate se datorează formării radicalilor hidrură. OH și H, molecule de hidrogen, peroxid de hidrogen și, de asemenea, ioni de hidrogen:
Atunci când o radiografie, Radiații, electronii rapizi și, în general, emisiile cu LET scăzut, predomină formarea de produse radicale, în timp ce în acțiune # 945; -particulele și alte radiații cu LET înalt, formarea de produse moleculare este mai importantă.
Electronii hidratați se formează aparent după hidratarea electronilor bătut în timpul ionizării. Radicalii hidroxilici și ionii de hidrogen ar trebui să fie obținuți, în principal, prin reacția:
atomi de hidrogen pot apărea parțial în disocierea moleculelor de apă și excitat de reacția care apar în urmele de particule, în care sunt prezente electroni hidratate simultan și ioni de hidrogen. Randamentul ridicat sub acțiunea unor produse moleculare cu high-LET radiatii pot reflecta faptul că, în acest caz, piesele sunt dense, astfel încât particulele de diferite pot de multe ori pentru a interacționa unii cu alții înainte ca acestea să poată să difuzeze în afara pistei și să reacționeze cu substanța dizolvată:
Aceste reacții presupun formarea ionilor intermediari OH - împreună cu alte particule din sistemul iradiat. Iones OH - observat într-adevăr în experiment. Produsele moleculare formate prin acțiunea radiației cu o LET scăzută pot să apară parțial în reacțiile apărute la pinteni, bloburi etc.