Obiectiv: determinarea indexului adiabatic pentru aer.
Pentru a determina exponentul adiabatic, folosim sistemul Clement-Desorma, al cărui schemă este prezentată în Fig. 1.1.
Fig. 1.1 Instalarea lui Clement-Desmor
La cilindrul 1 cu o capacitate de 10-15 litri, în care este localizat gazul de încercare, o pompă 2 conectată la robinetul 4 permite creșterea presiunii în comparație cu presiunea atmosferică. Presiunea în exces se măsoară cu ajutorul unui manometru de presiune în formă de U 3 peste diferențele dintre nivelele de lichid h din genunchi. Crane 5 servește pentru eliberarea pe termen scurt a gazelor.
Dacă gazul este pompat în cilindru (de exemplu aerul) la presiunea P1. mai mare decât P0. atunci starea gazului este caracterizată de parametrii P1. V1. T1 corespunde punctului 1 și pe diagrama PV (Fig. 1) (Atenție ce urmează litera V reprezintă volumul specific, adică volumul ocupat de o unitate de masă de gaz. Este convenabil pentru calcul, deoarece termenii masei experiențelor gazelor în navă se va schimba.)
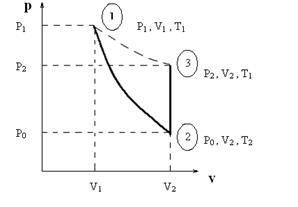
Fig. 1.2. Diagrama P-V a proceselor de gaz.
Dacă un timp scurt pentru a deschide supapa de sticla, atunci gazul va fi eliberat, iar presiunea din interiorul cilindrului va scadea la P0 atmosferică. În acest caz, extinderea gazului, datorită duratei sale scurte, poate fi considerată adiabatică. și anume care au loc fără schimbul de căldură cu mediul; Un astfel de proces este de asemenea numit izentropic. deoarece cu ea nu există nici o schimbare în entropie. Starea noului gaz va fi caracterizată de parametrii P0. V2. T2 (punctul 2 din figura 1). Deoarece, în conformitate cu prima lege a termodinamicii, gaz de lucru într-un proces adiabatic se produce din cauza scăderii energiei sale interne, temperatura gazului, astfel coborâtă, adică T2 <Т1. Переход из состояния «1» в состояние «2» описывается уравнением Пуассона для адиабатического процесса, следовательно:
unde g este exponentul adiabatic și, prin definiție, este egal cu:
unde Cp este căldura specifică a gazului la presiune constantă,
Cv este capacitatea de căldură a unui gaz la volum constant.
(Rețineți că capacitatea de căldură molară este cantitatea de căldură necesară pentru a încălzi 1 mol de substanță la 1 K.)
unde R = 8,31 J / (mol K) este constanta gazului universal; raportul Cp / Cv = (i + 2) / i, (1.4)
unde i este numărul de grade de libertate ale moleculelor gazului investigat: pentru un gaz monatomic i = 3, pentru un gaz diatomic i = 5, pentru un gaz poliatomic i = 6.
Uneori după închiderea macaralei, gazul rămas în cilindru va fi încălzit la un volum constant la temperatura ambiantă T1. În același timp, presiunea sa crește până la valoarea lui P2 (punctul 3 din figura 1). În metoda Clement-Desmorff, măsurarea presiunii este efectuată folosind un manometru în formă de U (vezi figura 2); h scădere nivelmetru lichid permite îndoituri pentru determinarea presiunii gazului în P1 și P2 cilindru, respectiv:
Starea finală (punctul 3) și starea inițială (punctul 1) a gazului corespund aceleiași temperaturi T1 și sunt legate de ecuația Boyle-Marriott pentru procesul izotermic:
Pentru a obŃine formulele referitoare la exponentul adiabatic cu parametrii măsuraŃi, ridicăm ecuaŃia (1.5) la puterea g și împărŃim termenul pe termen în ecuaŃia (1.1):
Logaritmul ecuației (1.7), găsim:
Să exprimăm presiunea gazului prin diferența dintre nivelele de lichid din manometru, înlocuind (1.5) în ecuația (1.8). Avem
sau după transformare:
Raportul h1 / P0 și (h1 -h2) / P0 este mult mai mic decât unitatea, prin urmare, folosind formula aproximativă ln (1-x) @ x pentru valori mici de x. obținem din (1.10)
Această formulă este calculată pentru determinarea exponentului adiabatic g.