Sindromul congenital de noonan este o consecință a stimulării căii RAS-MAPK și este caracterizat prin leziuni multisistemice
Sindromul Noonan este o boală multisistemă dominantă autozomală dominantă, exprimată variabil, cu o prevalență estimată de 1 caz la 1000-2500 de persoane. Pentru prima dată, Kobylinsky la menționat în 1883.
Boala este descrisa Jacqueline Noonan au raportat noua pacienti cu stenoza pulmonara valve, statură mică, hypertelorism, scădere moderată a inteligenței, ptoză, criptorhidie și scheletic. Dr. Noonan, practicat ca un cardiolog pediatru la Universitatea din Iowa, am observat că copiii cu un tip rar de boli de inima - stenoza de valva pulmonara - a observat adesea anomalii fizice tipice în formă de statură mică, gât pterigion, larg set ochi și urechi joase. Băieții și fetele erau la fel de uimiți. Dr. John Opitz, un fost student al Noonan, a inventat primul termenul de „sindrom Noonan“ pentru a descrie starea copiilor, dintre care toți au avut simptome similare cu cele descrise Noonan. Noonan mai târziu, a scris un articol „fenotip hypertelorism Turner“, iar în 1971, la simpozion bolilor cardiovasculare cunoscut sub numele de „sindrom Noonan“ a fost recunoscut în mod oficial.
RAS-MAPK - o foarte importanta cale de transducție a semnalului prin care liganzi extracelulari - factori de creștere specifici, citokine și hormoni - stimulează proliferarea celulară, diferențierea, supraviețuirea și metabolismul (Figura 1). După legarea receptorilor de ligand pe suprafața celulei sunt fosforilate în locurile lor din regiunea endoplasmic. Acest lucru implică legarea de proteine adaptor (de exemplu, Grb2), care formează un complex cu factori de schimb nucleotidic guanina constitutivă (de exemplu, SOS), conversia inactive RAS GDF- legate de forma sa legată de GTP activă. proteina RAS activată, este activat RAF-MEK-ERK în cascadă printr-o serie de reacții de fosforilare. ERK rezultat activat pătrunde în miez pentru a modifica ținta transcrierea genei și corectează activitatea țintă pentru a induce răspunsuri citoplasmatici pe termen scurt adecvate și celule pe termen lung la stimuli. Toate genele implicate in sindromul Noonan, codifica parte integranta a acestei cai proteine. și mutații. cauzând boala, amplifică de obicei semnalul care trece prin această cale.
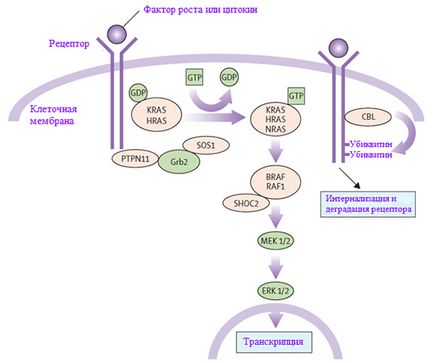
Figura 1. Traiectorie de semnalizare RAS-MAPK. Semnalele de creștere sunt transmise la nucleu cu factori de creștere ai receptorilor activi. Mutațiile în PTPN11, Kras, SOS1, acestea și RAF1 asociate cu sindromul Noonan, și mutații în SHOC2 și CBL sunt asociate cu un sindrom Noonan fenotip similar.
Semne și simptome
Aproximativ 10% dintre pacienți au deficiențe auditive în intervalul de joasă frecvență, cauzate de pierderea auzului perceptiv. și 25% - în gama de înaltă frecvență. Ele sunt asociate, în special, cu anomalii structurale ale urechii interne, incluzând anomalii ale osului temporal.
Sindromul Noonan - a doua cauza cea mai frecventa de boli cardiace congenitale sindromic, care este înainte de un sindrom trisomia 21 manifestat de mai multe fenotipuri cardiovasculare. Cea mai frecventa este stenoza pulmonara, de multe ori cu klapanami- displazic (50-60%), cardiomiopatie hipertrofică (20%), iar apoi - defect septal atrial (6-10%), se observă foarte rar defect septal ventricular, stenoza trunchiului pulmonar periferic, canalul atrioventricular, stenoza aortica. anomalii ale valvei mitrale, constricția aortic și anomalii ale arterelor coronare. Cardiomiopatia hipertrofica poate fi ușoară sau severă, și există o prenatală vârstei adolescenților. Aproape 25% dintre pacienți mor din cauza insuficienței cardiace în primul an de viață, cu toate că rata de moarte subita este mai mic decât în cardiomiopatia hipertrofica familială.
Electrocardiograme prezintă adesea largi QRS complexele cu model predominant negativ în derivațiile piept la stânga și deviația axei spre stânga cu gigantul Q-val, uneori, chiar și la structura normală a peretelui inimii și a pieptului. Cu sindromul Noonan, sunt asociate anomalii cerebrovasculare: malformații arteriovenoase, anevrisme. hipoplazia vaselor posterioare și boala mea.
Posibila pigmentare anormală: nevii pigmentari multipli, pete de cafea cu lapte și lentigo. observate frecvent umerii keratoza pilaris si fata pot inhiba creșterea părului și sprâncene. Parul este adesea gros și curul, deși părul subțire, rar este de asemenea descris.
Greutatea și înălțimea la naștere sunt de obicei normale. Creșterea scăzută este o manifestare caracteristică a sindromului Noonan, deși creșterea pacienților adulți nu se modifică întotdeauna. Din moment ce un spurt de creștere pubertală este adesea deranjat sau întârziat, prevalența creșterii scăzute a sindromului Noonan este cea mai pronunțată în timpul pubertății.
În plus, îmbătrânirea scheletului este întârziată. În ultimii ani de adolescență, creșterea pacienților crește. Pacienții pot prezenta o deficiență a hormonului de creștere, disfuncție neurosecretorie și rezistență la hormon de creștere. Pacienții cu sindromul Noonan asociat cu PTPN11 au deseori concentrații normale sau ușor crescute ale hormonului de creștere și concentrații scăzute de IGF1. Modelele experimentale ale sindromului Noonan Ptpn11 demonstrează activarea ERK ca răspuns la hormonul de creștere - o cauză potențială a creșterii scăzute și o țintă promițătoare pentru tratament. Dinamica creșterii este semnificativ îmbunătățită prin inhibarea ERK1 / 2.
Debutul perioadei pubertății a fost întârziat la pacienții cu sindromul Noonan comparativ cu populația în ansamblu; 35% dintre băieți intră în perioada pubertății de la vârsta de 13,5 ani și 44% din fetele de la 13 ani. Adulții pot fi expuși riscului de tulburare de osteogeneză asociată cu estrogenismul hipoglicemic masculin și resorbție osoasă crescută. Majoritatea copiilor care suferă de sindromul Noonan întâmpină dificultăți care pot duce la întârzierea creșterii. Există o alimentație slabă a sânului matern, un timp de hrănire prelungit sau vărsături recurente; aproximativ 25% dintre sugari ar trebui să fie hrăniți prin sondă în primele două săptămâni de viață sau mai mult. De asemenea, refluxul gastroesofagian este obișnuit. Aceste simptome dispar la copiii cu cea mai severa forma la a 15-a luna de viata. Au fost documentate încălcări ale rotației intestinale, mobilitatea imatură și întârzierea dezvoltării motilității gastrointestinale.
80% dintre băieții cu sindromul Noonan au criptorhidie unilaterală sau dublă. S-ar putea fi o disfuncție de gonade de sex masculin din cauza unei încălcări a funcției celulelor Sertoli și nu criptorhidie. Fertilitatea femeilor cu sindromul Noonan nu este încălcată. La 10% dintre pacienții cu sindromul Noonan există anomalii renale. dar majoritatea nu au nevoie de tratament.
Desi sugarii cu sindrom Noonan predispus la mai multe anomalii hematologice, inclusiv monocitoză temporare, trombocitopenie și bolile mieloproliferative, cele mai frecvente tulburari hematologice sunt sangerari din cauza unor defecte de coagulare.
Anomaliile limfatice, de obicei, edemul limfoid periferic, sunt prezente la aproximativ 20% dintre indivizi. Edemul limfoid periferic poate să apară la sugari și apare în primii ani de viață, dar uneori apare la pubertate sau la vârsta adultă. Efectele fecale sunt mai puțin frecvente; pulmonară, testiculară sau limfangiectasie intestinală; reziduurile de hip în cavitatea pleurală și abdominală; vasele limfatice hipoplazice ale picioarelor; vasele limfatice anormale ale pieptului; aplazia sau absența canalului toracic; hipoplastice vasculare limfatice inghinale și iliace; edemul limfoid al scrotului sau vulvei.
Leziunile cu celule gigante multiple sunt asociate cu sindromul Noonan cauzat de mutații în PTPN11 sau SOS1. Synovita villonodulară pigmentată - implicarea proeminenței sinoviale a articulațiilor, tendoanelor și pungilor - este adesea observată la pacienții cu sindromul Noonan. Aproximativ 30% din copii au deformare spinării, iar intervenția chirurgicală este recomandată în două din cele trei cazuri. Sunt descrise, de asemenea, deformări ale toracelui și mameloanelor (cubitus valgus și genu valgum).
Pacienții cu sindrom Noonan sunt predispuse la un număr de neoplazii hematologica, mai ales în copilărie, inclusiv leucemia mielomonocitară juvenilă, leucemie mielogenă acută și leucemia limfocitară limfoblastică B-acută. Tulburările mieloproliferative la pacienții cu sindrom Noonan și leucemie mielomonocitară juvenilă nu este de obicei la fel de pronunțată ca la pacientii cu leucemie mielomonocitară juvenilă.
rabdomiosarcom embrionar (duoden, vezica urinara, duct urinara, orbita, vagin si cavitatea abdominala), de obicei asociate cu mutația SOS1-germenativnoy. Pot exista și alte tumori: tumora granulyarnokletochnaya, astrocitom pilocytic, celule Sertoli tumorale in kriptorhicheskom testicul, neuroblastomul, alta tumora gliale (asociat cu mutația PTPN11-germinale). mutații patogenice ale PTPN11 duce la o creștere de cinci ori a riscului de cancer. De asemenea, descrise cazuri de mastocitoză maligne și angiosarcom epitelioida maligne.
La 95% dintre pacienți, se observă cel puțin o anomalie tipică a ochilor: strabism, erori de refracție, ambliopie sau nistagmus. Două treimi dintre pacienți au leziuni ale camerei anterioare, inclusiv cataractă, iar 20% dintre pacienți au modificări ale ochilor, inclusiv Druze și hipoplazia discului optic, coloboame și nervi mielinici.
Cele mai multe dintre caracteristicile sindromului Noonan se poate datora obstrucției sau disfuncții ale sistemului limfatic în timpul dezvoltării, inclusiv centura de gât și mușchii trapez flush, criptorhidie. șuvițele în poziție largă, urechile cu înălțime mică și întoarsă, hiperteleismul și ptoza. Alte caracteristici ale sindromului Noonan includ boala cardiacă congenitală, pectus carinatum superior cu pectus excavatum inferior, dezvoltarea întârziată, creșterea scăzută și displazia limfatică. Caracteristicile faciale asociate cu sindromul Noonan variază în funcție de vârstă (tabelul 1, figura 2).
Tabelul 1. Caracteristicile tipice ale feței la pacienții cu sindromul Noonan după vârstă
Caracteristici prenatale nespecifice, dar includ mnogogidramnion, hidronefroză, revărsat pleural, edem, defecte cardiace, saci limfatici jugulare mărite, higroma chistică și creșterea transparenței în regiunea occipitală. Pentru cromozomi fetale normale sindrom Noonan cu occipitală edem diagnosticat cu aproximativ 1-3% din cazuri, în primul trimestru și cistică higroma - 10% din fructele în al doilea trimestru.

Figura 2. Cinci generații de familie cu sindrom Noonan, cauzate de mutatii SOS1. Distincția caracteristicilor faciale devine mai ușoară odată cu vârsta.
Tabelul 2. Corelațiile dintre genotip și fenotip în sindromul Noonan *
Tratamentul și diagnosticul diferențial
Recomandări pentru tratamentul sindromului Noonan sunt descrise în tabelul 3. Cu toate caracteristicile faciale caracteristice și alte complicații asociate cu Noonan tulburări de sindrom asemănător, același tip de sindrom Noonan, mutatii in alte doua gene - SHOC2 si CBL - sunt asociate cu caracteristici suplimentare nu au fost observate în sindromul Noonan.
Tabelul 3. Recomandări privind tratamentul
În timpul perioadei de diagnosticare
Examinarea fizică și neurologică completă; consultații genetice medicale pentru a confirma diagnosticul, eventual testarea genetică moleculară și consilierea genetică
Examen fizic și neurologic complet anual; testarea genetică repetată pentru un genotip negativ sau pentru o cercetare multisistemică; consiliere genetică pentru adolescenți sau adulți tineri
Orchopexie la vârsta de 1 an cu criptorhidism; în prezența edemului limfoid - tratament într-o clinică specializată; cu o creștere a presiunii intracraniene - RMN a creierului si a maduvei spinarii de col uterin; pentru convulsii suspectate - o electroencefalogramă și o trimitere la un neurolog
Evaluarea dezvoltării multidisciplinare
Analiza anuală a dezvoltării pentru copii cu vârsta cuprinsă între 5 și 18 ani
Testarea la neuropsiholog în cazul în care screening-ul a relevat anomalii; intervenția timpurie în cazul în care întârzierea este detectată până la trei ani; plan individual de instruire pentru copiii cu vârste cuprinse între 5-18 ani cu întârziere în dezvoltare