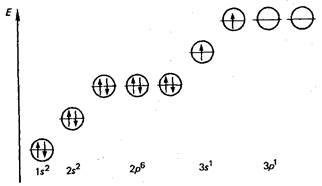
În starea normală, atomii acestor elemente nu au electroni neparticipați, dar în tranziția atomilor către starea excitată, unul dintre electronii s-valenți se îndreaptă spre p-subsol.
Aceasta determină gradul de oxidare +2. De exemplu, atomul de magneziu în stare excitat are următoarea formulă electronică.
Gradul de oxidare este mai mare decât +2 elemente ale grupului IIA.
în ciuda faptului că numărul de electroni de valență pentru atomii elementelor s din grupul IIA este același, proprietățile magneziului și, în special, beriliul diferă semnificativ de proprietățile metalelor alcalino-pământoase. Aceasta din urmă se datorează în primul rând diferenței semnificative în raza atomilor și a ionilor lor.
Diferența în proprietățile beriliului se datorează și faptului că electronii de valență sunt precedați de o cochilie cu două electroni. În plus, proprietățile chimice ale beriliului și magneziului diferă de proprietățile metalelor alcalino-pământoase datorită faptului că calciul, stronțiul, bariul și radiul au d-orbitale libere aproape de energie în orbitalii ns.
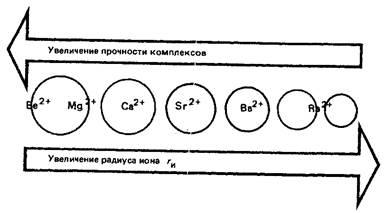
Beriliul este similar în multe privințe cu aluminiul (similitudinea diagonală în sistemul periodic). Raza atomului și a ionului de beriliu este semnificativ mai mică în comparație cu celelalte elemente s ale grupului. În consecință, energia de ionizare a atomului de beriliu este mult mai mare decât în celelalte elemente s-a grupului IIA. Spre deosebire de magneziul și metalele alcalino-pământoase, beriliul este un element amfoteric, caracterizat în mare măsură printr-o legătură covalentă cu atomii altor elemente. În condiții obișnuite, beriliul nu este simplu, ci ioni complexi. În seria Be + -Mg2 + -Ca2 + -Sr2 + -Ba2 +, puterea complexelor cu liganzi care conțin oxigen și alți liganzi scade:
Capacitatea ionului Be2 + de a forma complexe mai puternice decât ionul Mg2 + cu liganzi, fluoruri și altele prezente în organisme vii, cauzează efectul toxic al acestui cation.
De exemplu, ionul de beriliu suprimă activitatea a numeroase enzime activate de ionul Mg ca urmare a înlocuirii ionilor de magneziu în complexele sale cu enzime, acizi nucleici și alte bioligandi care conțin grupări fosfat:
Complexele complexe de beriliu tetraedru (sp3-hibridizarea orbitalilor) cu fosfați sunt ușor solubile în comparație cu complexele octaedrice mai puțin puternice de magneziu (sp3d2-hibridizarea orbitalilor). Ca urmare a reacției de substituție, beriliul introdus în organism îndepărtează fosforul (grupările fosfat) din organisme sub forma unui complex puternic. La rândul său, aceasta duce la o scădere a conținutului de calciu din organism. Astfel, ca urmare a intrării beriliului, se produce boala "rahitismul de beriliu". Deoarece reacția de mai sus este reversibilă, introducerea unui exces mare de săruri de magneziu conduce la o deplasare a echilibrului spre stânga (principiul Le Chatelier) și la restabilirea activității enzimatice.
Magneziul și beriliul sunt antagoniști, adică adăugarea unui element duce la deplasarea celuilalt. De aceea, atunci când se otrăvește cu săruri de beriliu, se introduce un exces de săruri de magneziu. Datorită toxicității compușilor de beriliu în practica medicală, acestea nu sunt utilizate ca medicamente.
Magneziul și beriliul diferă substanțial în dimensiunile atomilor și ionilor. Dimensiunea mai mare a ionului de magneziu determină, de asemenea, numărul mai mare de coordonare a acestui ion, în general egal cu 6 în compușii complexi cu bioligandi. Legăturile chimice ale ionului de magneziu cu oxigenul donor și atomii de azot ai bioliganzilor sunt mai ionici decât cei ai ionului de beriliu. Spre deosebire de toți ceilalți cationi ai grupului IIA, pentru care coordonarea cu atomii de oxigen este preferabilă, ionii Mg + sunt coordonați predominant cu atomii de azot.
Compușii compuși de magneziu joacă un rol imens în activitatea vitală a organismelor vegetale și animale.
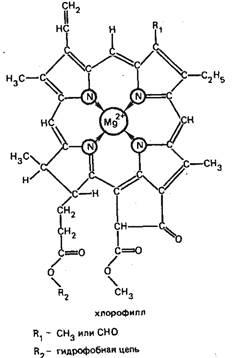
Astfel, de exemplu, ionul Mg2 + este un agent de complexare în pigmentul plantelor verzi - compusul clorofil-bileorganic, care joacă un rol important în procesul de fotosinteză:
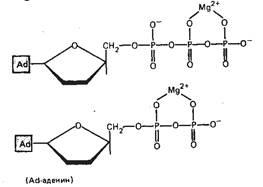
Reacțiile de formare complexă sunt scrise astfel:
Mg2 + + ATP4- ↔MgATF2-
Mg2 + ADP3-MgADP-
În multe reacții enzimatice în care ATP servește ca donator al grupării fosfat, forma activă a ATP este complexul MgATP2-. Trebuie notat faptul că stabilitatea ribozomilor depinde de concentrația de ioni de Mg2 +. Ionul Mg2 + formează șase compuși coordonați ai unei structuri obișnuite spre deosebire de ionul mare de Ca2 +.
Calciul prezintă numerele de coordonare 6, 7 sau 8 și formează complexe asimetrice. O posibilă consecință este rolul biologic diferit al acestor elemente în organismele vii. Capacitatea ionilor de Ca2 + de a forma compuși complexi de structuri diferite le permite să se "adapteze" cu ușurință la atomii donatori ai bio-liganzilor care le înconjoară și să servească drept punți între liganzi. Evident, acesta este motivul pentru care ionul de Ca2 + este mult mai eficient decât ionul de magneziu ca o punte între doi liganzi în spațiul extracelular.
Este interesant de observat că ionul de Ca2 + este de obicei un antagonist al ionului Mg2 + în procesele biochimice. Totuși, acest lucru nu este surprinzător, deoarece caracteristicile fizico-chimice ale acestor elemente sunt semnificativ diferite (= 148 kJ / mol, numere de coordonate diferite, etc.). Astfel, ionii de Ca2 + suprimă activitatea multor enzime activate de ioni de Mg2 +, de exemplu adenozin trifosfatază.
Antagonismul ionilor de calciu și magneziu se manifestă prin faptul că, spre deosebire de magneziu, ionul de calciu este un cation extracelular. Cu aportul prelungit de cantități excesive de săruri de magneziu din organism, se observă o eliberare crescută de calciu din țesutul osos și unele proteine.
Se observă sinergismul ionilor de magneziu și calciu în activarea anumitor enzime, însă în majoritatea cazurilor ionul de Mg2 + este un activator al enzimelor intracelulare, iar ionul de calciu este extracelular.
Proprietăți fizico-chimice mult mai apropiate ale ionului de magneziu și Mn2 + de ioni de mangan. Ca o consecință, acesta din urmă acționează adesea ca un sinergist al ionului Mg2 +. De exemplu, ambii acești ioni activează enzime cum ar fi diferite fosfataze etc. Se presupune că apare activarea enzimei aminopeptidazei leucinice cu ioni Mg2 + și Mn2 +. datorită formării complexului:
unde M2 + -Mg2 + sau Mn2 +.
Deoarece calciul are caracteristici fizico-chimice (raza ionică, energia de ionizare, numere de coordonare) aproape de stronțiu și bariu, atunci, de regulă, ionii acestor elemente sunt sinergici ai ionului de calciu. Similaritatea dimensiunilor ionilor de calciu și stronțiu conduce la prezența unei impurități constante de stronțiu în organism.