Chimie Organică. Structura moleculară A. COMPUȘI CU CARBON CHIMIC
Natura chimică a carbonului, intermediar între metale și nemetale tipice îi permite să formeze legături covalente cu multe elemente, de multe ori cu hidrogen, oxigen, azot, halogen, sulf și fosfor. Carbonul formează legături cu un grad înalt de caracter ionic, cu metale mai electropositive, dar astfel de substanțe sunt foarte reactive și sunt utilizate ca intermediari în sinteză. Legăturile carbon-carbon au un caracter covalent și sunt simple (simple), duble, triple și aromatice
(vezi Structura moleculară).
Sisteme aromatice. Benzenul - fondatorul clasei de compuși aromatici - are o stabilitate unică și intră în reacții chimice, diferite de reacțiile sistemelor nearomatice. Există și alte sisteme aromatice, cele mai obișnuite dintre acestea având p-orbitale disponibile pentru formarea legăturilor p, pe fiecare atom de inel. Sistemele de inel cu cinci membri cu două legături duble conjugate (de exemplu, alternante cu simple) și un al cincilea atom care poartă o pereche de electroni împărțite în comun sunt de asemenea aromatice în proprietățile lor. Mai jos sunt câteva dintre aceste sisteme:
Conceptul de aromatizare a fost generalizat de chimistul german E. Hückel. Conform regulii Huckel, sistem conjugat ciclic plat cu numărul de electroni p egal cu 4n + 2, aromaticitate și stabil, și același sistem cu numărul de electroni p-4n - antiaromaticity și instabilă.
Stabilitatea sistemelor ciclice. Unghiul Bond (unghiul dintre legături) în fragmentul neaccentuate C-C din 109B °, iar inelul în care este stocată valoarea să fie mai stabile decât cele în care unghiurile se abat puternic de la această valoare. Tensiunea produsă în sisteme ciclice ca urmare a denaturării unghiurilor de legătură, se numește Bayer - după chimist german A. Bayer, a propus mai întâi această durabilitate explicație inele saturate. Astfel, în inelele cu trei atomi, unde unghiul de valență de numai 60V °, inel foarte tensionat și ușor de rupt; unele dintre reacțiile lor amintesc de dubla legătură C = C. Inele cu patru membri sunt, de asemenea, stresate (unghiul de valență 90 °), dar nu atât de mult. Inelele cu cinci membri sunt aproape plane și unghiurile lor sunt de 108 °; astfel încât acestea sunt relaxate și stabile. Inelele cu șase membri, cum ar fi ciclohexan, atomii de carbon nu se află în același plan; aceste bucle sunt pliate, reducându-se astfel inelul de tensiune. Inelele cu cinci și șase membri sunt cele mai comune. inele mari, de asemenea, posibilitatea de a scădea tensiunea de ridare unghiulară, dar în unele dintre ele (de șapte până la doisprezece atomi) atomi de hidrogen sunt pe părți opuse ale inelului mai aproape împreună, astfel încât repulsia face chimist le compus mai puțin stabil (tensiune prelogovskoe de numele unei V.Preloga elvețian , care a descoperit acest efect).
Tautomerism. Dacă o moleculă sau ion poate fi reprezentat de mai multe structuri care diferă una de cealaltă distribuție numai de electroni, aceste structuri sunt numite de rezonanță, și formele de rezonanță nu sunt în echilibru una cu alta prin simpla structura electronică reală a moleculei este ceva între aceste extreme. Cu toate acestea, există situații în care atomii se mișcă în moleculă în condiții normale atât de rapid încât echilibrul se stabilește spontan între formele moleculare diferite. Acest fenomen se numește tautomerism. Un exemplu este echilibrul dintre cetonă și enol (tautomerismul ceto-enol):
Aici, doi compuși diferă numai în locația cationului de hidrogen și a perechii de electroni (în legătura p). Echilibrul este stabilit rapid, dar puternic mutat spre forma ceto. În consecință, cu alcooli din -C structura = C-OH este de obicei instabil și se transformă rapid în forma ceto, dacă nu unele caracteristici structurale care stabilizează forma enol, de exemplu, fenoli care la trecerea la forma keto-ar pierde caracterul aromatic:
Tautomerie convenționale în molecule având structura -CH = X sau -C = XH, unde X - este S, O sau N. Astfel, molecula H2C = C (NH2) -CH3 rearanjeaza rapid la H3C-C (= NH) - CH3 și imidele RC (OH) = NH sunt rearanjate în amide RC (= 0) NH2. Tautomerismul este comun în sistemele heterociclice importante din punct de vedere biologic, cum ar fi acidul barbituric și compușii înrudite:
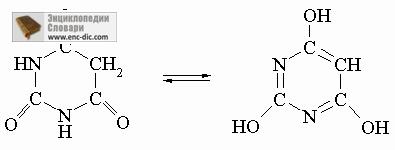
Alte echilibre rapide. Sunt cunoscute și alte echilibre rapide între moleculele cu structuri similare. Dacă, cu același atom de carbon, sunt localizate oricare două grupări OH, SH sau NH2, compusul este de obicei instabil în comparație cu forma dublu legată:
Există cazuri când acest echilibru este mutat către compusul dihidroxi. Formaldehidă gazoasă are structura CH2 = O, dar în soluție apoasă se atașează o moleculă de apă, obținându-se HO-CH2-OH ca formă predominantă. Cl3CCH (OH) 2 cloral hidrat este stabil în forma dihidroxil ca urmare a efectului de retragere a electronilor a trei atomi de clor.
B. ISOMERIA
Isomerismul lanțului de carbon. Moleculele care diferă numai prin ramificarea lanțului de carbon se numesc izomeri de lanț. Un exemplu a fost deja dat - aceasta este o pereche izomerică de n-butan și izobutan.
Isomerismul grupurilor funcționale. Moleculele cu formule brute identice, dar diferite grupări funcționale, sunt izomeri funcționali, de exemplu alcool etilic C2H5OH și dimetil CH3-O-CH3.
Isomerismul poziției. Izomerii poziționali au formule și grupări funcționale identice, dar pozițiile grupelor funcționale din moleculele lor sunt diferite. Astfel, 1-clorpropan CH3CH2CH2CI și 2-clorpropan CH3CHCICH3 sunt izomeri poziționali.
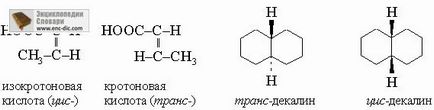
Izomerismul geometric. Izomerii geometrici constau din atomi identici conectați în aceeași secvență, dar diferă în aranjamentul spațial al acestor atomi în ceea ce privește dublule legături sau inele. Izomerismul cis-trans al olefinelor și sin-anti-izomerismul oximelor se referă la acest tip.
Ajutor pentru motoarele de căutare