Sulful este larg răspândit în natură. Este de 0,05% din masa crustă a pământului. În stare liberă (sulf natal), în cantități mari, găsite în Italia (insula Sicilia) și în Statele Unite. Depozitele de sulf natural se găsesc în regiunea Kuibyshev (regiunea Volga), în statele din Asia Centrală, în Crimeea și în alte regiuni.
Sulful se găsește adesea sub formă de compuși cu alte elemente. Cei mai importanți compuși săi naturali sunt sulfurile metalelor: FeS2 - pirita sau pirita; HgS - purpura etc. și săruri ale acidului sulfuric (hidrat cristalin) :. CaSO4 ּ 2 H2O - gips, Na2SO4 ּ 10 H2O - sare Glauber, MgSO4 ּ 7 H2O - sare Epsom și colab.
Proprietățile fizice ale sulfului
Sulful natural constă dintr-un amestec de patru izotopi stabili:
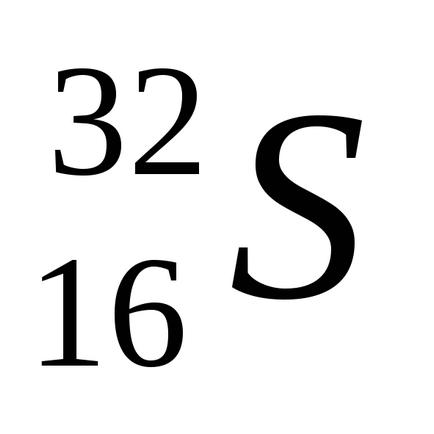

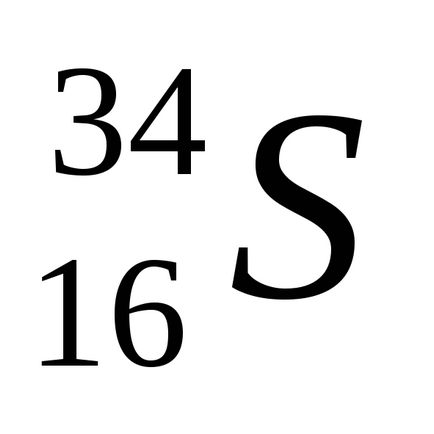
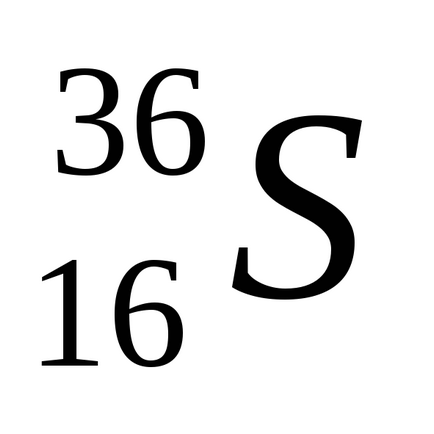
Sulful formează mai multe modificări alotrope. Stabil la temperatura camerei rombic de sulf este o pulbere de culoare galbenă, slab solubil în apă, dar solubilă în sulfură de carbon, anilină și alți solvenți. Rău conduce căldură și electricitate. Cristalizarea din hloroformaCHCl3 serouglerodaCS2 sau ea se află într-o formă transparentă cristalină octaedru. Sulful rombic constă în molecule ciclice. în formă de coroană. La 113 ° C, punctul de topire se transformă într-un lichid galben, ușor de mișcat. Cu încălzire suplimentară, topitura se îngroașează, deoarece se formează lanțuri de polimeri lungi. Și dacă sulful este încălzit la 444,6 ° C, se fierbe. Vărsarea de fierbere sulf flux subțire în apă rece poate poluchitplasticheskuyu sulf - modificat cu cauciuc, constând din lanțuri polimerice. Cu răcirea lentă a topiturii, se formează cristale de ac de galben închis de sulf monoclinic. (punct de topire = 119 ° C). Ca sulful rombic, această modificare constă din molecule S8. La temperatura camerei, sticla din plastic și monoclinic sunt instabile și transformate spontan în pulbere de sulf romantic.
Proprietăți chimice ale sulfului și ale compușilor săi
Proprietățile unei substanțe simple.
Un atom de sulf, având un nivel de energie extern incomplet, poate atașa doi electroni și poate prezenta o stare de oxidare de -2. Acest grad de oxidare a sulfului se manifestă în compuși cu metale și hidrogen (de exemplu, Na2S și H2S). Atunci când electronii sunt eliberați sau trași înapoi la atomul elementului mai electronegativ, gradul de oxidare a sulfului poate fi +2, +4 și +6.
Sulful formează cu ușurință compuși cu multe elemente. Atunci când este ars în aer sau în oxigen, oxidul de sulf (IV) SO2 și oxidul de sulf (VI) SO3 parțial:
2S + 3o2 = 2so3
Acestea sunt cele mai importante oxizi ai sulfului.
Prin încălzirea directă a sulfului combină cu hidrogen, halogen (altele decât cele de iod), fosfor, carbon, și, de asemenea, cu toate metalele, cu excepția aur, platină și iridiu. De exemplu:
3S + 2p = p2s3
2S + c = cs2
După cum rezultă din exemple, în reacțiile cu metale si unele nemetale este un sulf agent de oxidare, în reacțiile cu nemetale mai active, cum ar fi oxigenul, clorul, - cu un agent reducător.
Dioxidul de sulf SO2 este un gaz incolor cu un miros asfixios și mirositor. Când se dizolvă în apă (la 0 ° C, volumul de apă dizolvă mai mult de 70 de volume de SO2), se formează H2SO3 de acid sulfuric. care este cunoscut numai în soluții.
În condiții de laborator, pentru a obține S02, ele acționează pe sulfit de sodiu solid cu acid sulfuric concentrat:
În industrie, SO2 este produs prin prăjirea minereurilor sulfuroase, cum ar fi pirita: