Caracteristici generale ale azotului
Azotul este al șaptelea element al mesei periodice. Denumirea este N din azotul latin. Situat în a doua perioadă, VA grup. Se referă la metale nemetalice. Încărcarea nucleului este de 7.
Cea mai mare parte a azotului este în stare liberă. Azotul liber este constituentul principal al aerului, care conține 78,2% (v / v) de azot. Compușii azotați anorganici nu apar în natură în cantități mari, cu excepția azotatului de sodiu NaNO3. formând un strat puternic pe coasta Pacificului din Chile. Solul conține cantități mici de azot, în principal sub formă de săruri de acid azotic. Dar sub formă de compuși organici complexi - proteine - azotul face parte din toate organismele vii.
Sub forma unei substanțe simple, azotul este un gaz incolor care este inodor și foarte puțin solubil în apă. Este puțin mai ușor decât aerul: masa de 1 litru de azot este de 1,25 g.
Masa atomică și moleculară a azotului
Masa atomică relativă a unui element este raportul dintre masa unui atom dintr-un element dat și 1/12 din masa unui atom de carbon. Masa atomică relativă este nesemnificativă și este notată de Ar (indicele "r" este litera inițială a cuvântului englez relativ, care în traducere înseamnă "relativă"). Masa atomică relativă a azotului atomic este 14,0064 amu.
Masele de molecule, precum și masele de atomi, sunt exprimate în unități de masă atomică. Masa moleculară a unei substanțe este masa unei molecule, exprimată în unități atomice de masă. Masa moleculară relativă a unei substanțe este raportul dintre masa unei molecule dintr-o substanță dată și 1/12 din masa unui atom de carbon a cărui masă este de 12 amu. Se știe că molecula de azot este diatomică - N2. Greutatea moleculară relativă a moleculei de azot va fi:
Izotopi de azot
În natură, azotul există ca doi izotopi stabili de 14 N (99,635%) și 15 N (0,365%). Numărul lor de masă este de 14 și respectiv 15. Nucleul atomului izotopului de azot 14 N conține șapte protoni și șapte neutroni, iar izotopul 15 N - același număr de protoni și șase neutroni.
Există paisprezece izotopi artificiali de azot cu număr de masă de la 10 la 13 și de la 16 la 25, dintre care cel mai stabil este izotopul de 13 N cu un timp de înjumătățire de 10 minute.
Ioni de azot
La nivelul energiei externe a atomului de azot, există cinci electroni care sunt valenți:
Schema structurii atomului de azot este prezentată mai jos:
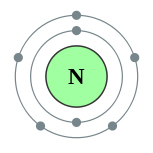
Ca rezultat al interacțiunii chimice, azotul își poate pierde electronii de valență, adică să fie donatorul lor și să se transforme în ioni încărcați pozitiv sau să ia electronii unui alt atom, adică să fie acceptorul lor și să se transforme în ioni încărcați negativ:
N-5e → N2 +;
N-4e → N4 +;
N-3e → N3 +;
N0-2e → N2 +;
N 0-1e → N 1+;
N 0 + 1e → N 1-;
N 0 + 2e → N 2;
N 0 + 3e → N 3-.
Molecule și atomi de azot
Molecula de azot constă din doi atomi - N2. Iată câteva proprietăți care caracterizează atomul și molecula de azot: