Metodele de preparare a hidrocarburilor din seria divinyl nu diferă, în cele mai multe cazuri, de metodele de producere a olefinelor, numai reacțiile corespunzătoare trebuie efectuate de două ori, sau compușii care conțin deja o dublă legătură ar trebui utilizați ca materie primă.
Divinilul și izoprenul sunt produse în industrie prin dehidrogenarea amestecurilor butano-butilenă sau izopentan-izo-metilenă, de obicei peste catalizatorii care conțin Cr2O3:
2. Metoda SV Lebedev a jucat un rol foarte important în producția industrială de divinil:
3. Divinil, izopren, diizopropenil se obține prin deshidratarea glicolilor:
4. Cloroprenul se obține prin adăugarea de acid clorhidric în vinilacetilen:
Proprietățile fizice ale 1,3-alcadienelor
Divinilul în condiții obișnuite este gazul. Isoprenul și alte alcadiene simple sunt lichide. Regulile obișnuite inerente seriei omogene de hidrocarburi sunt valabile și în această serie.
Pentru alcaldienii cu legături duble conjugate, sunt caracteristice indicii de refracție anormal de înaltă. Datorită acestei caracteristici, refracțiile moleculare ale alcadienilor găsite sunt mult mai mari decât cele calculate. Diferența dintre valorile calculate și calculate este de obicei 1 ÷ 1,5 unități. Se numește exaltare moleculară.
Caracteristicile chimice ale 1,3-alcadienelor
Două legături π conjugate formează un nor electronic comun - toți cei patru atomi de carbon se află în starea de sp2-hibridizare (vezi capitolul 2). Aceasta duce la scurtarea legăturii simple (până la 0,146 nm) și la stabilizarea moleculei. De exemplu, energia formării unei molecule divinil este de 14,6 kJ / mol mai mare decât energia calculată de formare a unei hidrocarburi cu aceeași compoziție, dar fără a ține seama de conjugarea dublelor legături. Această diferență se numește energia de rezonanță. Această caracteristică în structura hidrocarburilor dienice le face capabile să conecteze diferite substanțe nu numai cu privire la una dintre legăturile duble, ci și la atomii terminali ai sistemului conjugat - la pozițiile 1,4 cu deplasarea dublei legături. O astfel de atașare este determinată de efectul dinamic al conjugării, adică redistribuirea densității electronice a unei molecule sub influența unui agent de atac.
Hidrogenul excitant catalitic este atașat la pozițiile 1,2 și 1,4:
Halogenul este, de asemenea, capabil să unească sistemele conjugate în pozițiile 1,2 și 1,4:
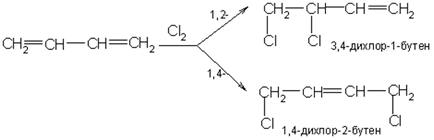
Ca și în cazul hidrocarburilor etilenice, adăugarea poate avea loc fie prin mecanism ionic, fie prin mecanism radical.
Sub mecanismul de atașare ionică, complexul p (I) format inițial se transformă rapid într-un ion de carboniu conjugat cu o sarcină pozitivă pe al doilea și al patrulea atom de carbon. Acest ion poate fi reprezentat fie de două formule de limită (II), fie de o formulă (III). Această carbocare dă anionul halogen pentru a forma produse de adiție de 1,2 și 1,4:
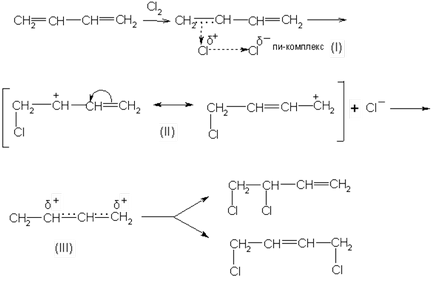
În reacțiile de adiție de halogenuri de hidrogen, se aplică aceleași legi:
Aciziile hohohalogenate și eterii lor se adaugă predominant la poziția 1,2:
Când sunt încălzite, moleculele de hidrocarburi dienice sunt capabile să se atașeze una de alta în așa fel încât unul dintre ele să reacționeze în 1,2 și celălalt în pozițiile 1,4. Simultan, în cantități mici se formează un produs, când ambele molecule reacționează în poziția 1,4:
Hidrocarburile diene sunt dimerizate în mod deosebit cu molecule având o dublă legătură activată. Reacțiile de acest tip sunt numite sinteze diene sau reacții Diels-Alder:
O caracteristică importantă a hidrocarburilor dienice cu legături conjugate este capacitatea lor de a polimeriza în produse asemănătoare cauciucului.
Interesul industrial este polimerizarea în lanț a hidrocarburilor dienice sub influența catalizatorilor sau inițiatorilor. Metalele alcaline, compuși organometalici sunt utilizați ca catalizatori, peroxizii organici și anorganici sunt utilizați ca inițiatori.
În polimerizare, moleculele individuale de monomeri pot fi conectate unul la celălalt în poziții 1,2-, 1,4 sau o moleculă reacționează la 1,2- și cealaltă - la poziția 1,4:
Rata de polimerizare depinde de structura dienelor și de condițiile de polimerizare. Substituenții din mijlocul moleculei facilitează și, la sfârșitul moleculei, fac polimerizarea dificilă. Isoprenul polimerizează mai repede, iar piperylenul este mai lent decât divinilul.
Cele mai valoroase produse sunt obținute prin polimerizare stereoregulară (ordonată spațial) în poziția 1.4 cu formarea configurației cis a fiecărui reziduu:
Compoziția și structura chimică a cauciucului natural este un cis-polimer izopren stereospecific.
Structura cauciucului și a altor polimeri ai hidrocarburilor dienice a fost demonstrată prin metoda ozonizării (conform lui Harriesu). Prepararea în ozonoliză a aldehidei levulinice confirmă o structură 1,4 comandată.
Diferite tipuri de cauciuc sintetic și natural sunt utilizate pe scară largă în industrie. Uniunea Sovietică a fost un pionier în organizarea producției industriale de cauciuc sintetic pe scară largă.
PROVOCĂRI PENTRU AUTO-RAFINARE
1. Se calculează masa (g) de 1,3-butadienă formată ca urmare a dehidrogenării a 20 dm3 de butan (nu), dacă randamentul butadienei este de 50%.
2. Când se trece de 200 dm 3 (la n. Y.) vapori de alcool etilic în prezența unui catalizator de deshidratare și deshidratant gaz 90 dm 3 a fost obținut (la n. Y.) butadienă. Determinați randamentul reacției.
3. Se calculează masa maximă (g) de brom care se poate alătura 1,3-butadienei, dacă volumul său este de 12 dm 3 (condițiile sunt normale).
4. La oxidarea hidrocarburilor nesaturate se obține Garriesu acetonă a cărui masă a fost egală cu 29-a definit în masă (în g) de hidrocarbură nesaturată, nereacționat, bazată pe presupunerea că produsul randament ozonoliză - cantitativ.
5. Denumiți hidrocarburile după nomenclatura internațională
6. Scrieți formula structurală de 2,5-dimetil-4-izopropil-1,5-hexadienă.
3.4. ALKINS: definiție, izomerism, nomenclatură
Alchinii sunt hidrocarburi care conțin (Legătura triplă) într-o pereche de atomi de carbon. Formula generală pentru seria omologă de hidrocarburi acetilenice este CHN2n-2. Strămoșul acestei serii este acetilenă.
Izomerismul și nomenclatura
Hidrocarburile de acetilenă sunt denumite în conformitate cu nomenclatorul IUPAC, folosind aceleași reguli ca și în cazul hidrocarburilor limitative, dar sufixul "en" este înlocuit cu sufixul "in". Circuitul principal este selectat astfel încât să primească o legătură triplă și este numerotat de la capătul căruia se apropie legătura triplă.
Cele mai simple hidrocarburi acetilenice sunt adesea denumite acetilene alchil-substituite, adică pe nomenclatura rațională:
Izomerizarea hidrocarburilor acetilene este determinată atât de structura scheletului de carbon, cât și de poziția legăturii triple.
Hidrocarburile de acetilenă se obțin fie prin alchilarea acetilenei, fie prin despicarea hidrogenului halogenat sau a halogenurilor din compușii policalogeni.
1. Acetilena poate fi obținută prin cracarea la temperatură înaltă a metanului:
precum și în hidroliza carburii de calciu:
2. Alchilarea acetilenei se realizează prin transformarea acetilenului în compuși organometalici:
CH = C-Na + CH3J-CH = C-CH3 + NaJ
3. Hidrocarburile acetilene se formează prin acțiunea alcoolului alcoolic pe derivații dihalogen ai hidrocarburilor saturate care conțin halogeni la unul sau la atomii de carbon adiacenți:
Principalele regularități ale schimbării temperaturilor la fierbere și de topire din seria omoloagă de hidrocarburi acetilenice sunt similare cu regularitățile din seria de etilenă și hidrocarburi saturate.
Poziția legăturii triple din lanț afectează în continuare punctul de fierbere. Astfel, de exemplu, 1-butina se fierbe la 8,5 ° C și 2-butină la 27 ° C, în timp ce atât butanul, cât și toată butena în condiții normale sunt substanțe gazoase.
Densitatea și indicele de refracție al alchinelor sunt mult mai mari decât în cazul alchenelor și, în special, alcani.
Hidrocarburile de acetilenă au în benzile de absorbție caracteristice spectrului în infraroșu vibrațiile de întindere ale legăturii triple la 4,75 - 4,2 pm (2100-2300 cm-1.
Luând în considerare proprietățile chimice ale alchinelor să ia în considerare în special legătura triplă: în comparație cu alchene, alchine oarecum mai puțin activi în plus electrofile și mai activi în reacțiile cu nucleofile (apă, alcoolati, amine). Aceste caracteristici ale grupului acetilen sunt explicate prin structura sa. Ambii atomi de carbon din acetilenă se află în starea sp-hibrid. În același timp, cu atât mai mare proporția s-orbitali în stare hibrid, electronii sunt mai aproape de nucleu și, în consecință, mai dificile acești electroni implicați în procesul de transformare chimică care implică electrofili. Pe de altă parte, nucleele de carbon din acetilenă sunt mult mai accesibile pentru reactivii nucleofili datorită structurii lor liniare:
Același factor determină aciditatea semnificativă CH a grupării terminale acetilenice. Perechia electronică a legăturii CH în molecula acetilenă este mai aproape de nucleu decât în cazul etilenei, iar atomul de hidrogen este mai polarizat pozitiv.
Se adaugă hidrogen la locul legăturii triple în prezența acelorași catalizatori ca în locul de legătură dublă:
Adăugarea de halogeni (clor, brom, iod) la alchine prin mecanisme electrofile are loc și la o rată mai mică decât la olefine. Derivații de dihalogen nesaturați astfel formați pot fi separați din amestecul de reacție:
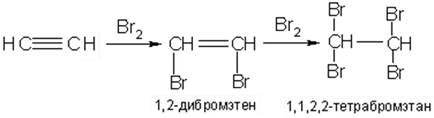
Adăugarea de halogenuri de hidrogen la alchini conduce la un amestec de hidrocarburi substituite cu etilen monohalogen și limitați de hidrocarburi dihalogen:
Reacțiile de adaos de halogeni și halogenuri de hidrogen la alchine pot avea loc prin mecanismul de adăugare electrofilă sau radicală. Când se unesc electrofile, se observă regula Markovnikov, cu un mecanism radical, se observă direcția opusă de atașare.
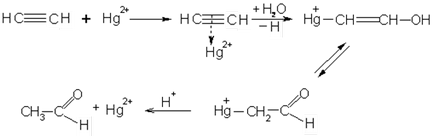
Alkinele atașează cu ușurință apă și acizi în contrast cu alkenele. Adăugarea de apă se efectuează în prezența sulfatului de mercur - reacția lui Kucherov. În același timp, aldehida acetică se obține din acetilenă, iar din omologii săi, cetonele:
Reacția acetilenei cu apă este utilizată în industrie pentru a produce aldehida acetică. Posibil mecanism al reacției lui Kucherov:
Alcoolii sunt adăugați la alchine în prezența alcoolaților. Această metodă produce esteri de vinii, precum și acetali:
Adăugarea de alcooli în prezența alcoolaților este o reacție tipică de adăugare nucleofilă. Mecanismul său poate fi reprezentat după cum urmează: