Un element chimic este o colecție de atomi cu aceeași încărcătură de nuclee atomice și același număr de electroni din carcasa atomică. Nucleul atomic este format din protoni. numărul cărora este egal cu numărul atomic al elementului și neutronii. al căror număr poate fi diferit [1]. Fiecare element chimic are numele latin și simbolul chimic alcătuit din una sau două litere latine, reglementate de IUPAC și date în special în tabelul tabelului periodic al elementelor lui Mendeleyev [2].
Forma existenței elementelor chimice într-o formă liberă sunt substanțe simple (un singur element) [3]. Este necesar să se facă distincția între elementele chimice (obiectele abstracte descrise prin caracteristicile lor) și obiectele lor materiale corespunzătoare - substanțe simple (care posedă anumite proprietăți fizico-chimice) [4].
Istoria conceptului [ ]
Cuvântul "element" (elementul latin) a fost folosit în antichitate (Cicero, Ovid, Horace) ca parte a ceva (element de vorbire, element de educație etc.). În antichitate, cuvântul "Cum se formează literele și corpurile - din elemente" a fost distribuit. Prin urmare, originea probabilă a acestui cuvânt: prin numele unei serii de litere consonante în alfabetul latin: l, m, n, t ("el" - "em" - "en" - "tum"). [6]
Aproape de înțelegerea modernă a conceptului de element chimic a reflectat un nou sistem de filozofie chimică, subliniat de Robert Boyle în cartea "Chemist-sceptic" (1661). Boyle a subliniat că nici cele patru elemente ale lui Aristotel, nici cele trei principii ale alchimistului nu pot fi recunoscute ca elemente. Elemente, în opinia lui Boyle - corpuri (substanțe) practic necorporale, constând din corpuri similare omogene (compuse din primul material). din care sunt compuse toate organismele complexe și la care pot fi descompuse. Corpuscul poate diferi în formă, dimensiune, masă. Corpuscul, din care se formează cadavrele, rămâne neschimbat în timpul transformărilor acestuia [7].
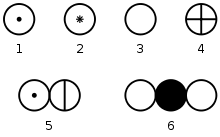
Simboluri ale elementelor chimice conform lui J. Dalton: 1 - hidrogen; 2 - magneziu; 3 - oxigen; 4 - sulf; 5 - amoniac; 6 - dioxid de carbon.
Mulțumită lui John Dalton la începutul secolului al XIX-lea. în chimie, ipoteza atomică-moleculară a predominat. luând în considerare un element chimic ca un tip separat de atomi și indicând natura substanțelor simple și complexe, care constau, respectiv, din atomi dintr-o specie sau dintr-o specie diferită. Dalton, pentru prima dată, indică greutatea atomică drept cea mai importantă proprietate a elementelor, care determină natura sa chimică. Datorită eforturilor lui Jöns Berzelius și a urmașilor săi, greutățile atomice (masele atomice) ale elementelor cunoscute au fost determinate foarte precis. La mijlocul secolului al XIX-lea. a fost marcată de o serie de descoperiri de elemente noi. La Congresul Internațional de Chimiști din Karlsruhe, în 1860, au fost adoptate definițiile conceptelor unei molecule și ale unui atom.
Odată cu descoperirea Legii periodice, DI Mendeleev (1869) cunoștea 63 de elemente. Greutatea atomică le-a fost atribuită ca proprietate a atomilor, determinând caracterul periodic al schimbării proprietăților elementelor chimice. precum și substanțele simple și complexe formate de aceștia. Mendeleev a definit elementele chimice drept "părțile materiale ale corpurilor simple sau complexe care le dau un anumit set de proprietăți fizice și chimice". Descoperirea lui Mendeleev a făcut posibilă prezicerea existenței, precum și a proprietăților unui număr de elemente necunoscute la momentul respectiv, și a servit drept bază științifică pentru clasificarea lor.
Cu toate acestea Mendeleev a fost forțată să facă mai multe permutări în elementele de secvență distribuite pe creșterea greutății atomice în scopul de a menține periodicitatea proprietăților chimice precum și celulele martor intră, elementele corespunzătoare nedescoperit. Mai târziu, a devenit clar că periodicitatea proprietăților chimice depind de numărul atomic (taxa nucleului atomic), mai degrabă decât de la masa atomică a elementului (în primele decenii ale secolului XX). Aceasta din urmă este determinată de numărul de izotopi ai elementelor stabile și de abundența lor naturală. Cu toate acestea, izotopi stabili ai elementului au masa atomică grupate în jurul unei anumite valori, deoarece izotopii cu un deficit de exces sau cu neutroni în nucleu instabil, și odată cu creșterea numărului de protoni (adică numărul atomic) numărul de neutroni, care formează împreună un nucleu stabil, de asemenea, crește. Prin urmare, o lege periodică poate fi formulată ca o dependență a proprietăților chimice de masa atomică, deși această dependență este încălcată în mai multe cazuri.
Odată cu descoperirea izotopilor, a devenit clar că chiar seturi diferite de atomi din același element pot avea diferite mase atomice; Astfel, heliul radiogen izolat din mineralele uraniului, datorită predominării izotopului 4 El, are o masă atomică mai mare decât heliul de raze cosmice (unde există și un izotop ușor de 3 He).
Înțelegerea modernă a elementului chimic ca un set de atomi, caracterizată de aceeași sarcină pozitivă a nucleului. egal cu numărul elementului din tabelul periodic, a apărut datorită lucrărilor fundamentale ale lui Henry Moseley (1915) și ale lui James Chadwick (1920) [9].
Elemente chimice cunoscute [ ]
Sinteza de noi (nu a fost găsit în natură) elemente având un număr atomic mai mare decât cea a uraniului (elemente transuraniene) sunt realizate folosind inițial captarea multiplă de neutroni de nuclee de uraniu sub flux de neutroni intens în reactoare nucleare și chiar mai intense - într-o nuclear (termonucleară ) a exploziei. Ulterior dezintegrarea beta nuclee de lanț de neutroni conduce la o creștere a numărului atomic și apariția nucleelor fiice cu număr atomic Z> 92. Neptuniu Astfel deschis (Z = 93), plutoniu (94), americiu (95), berkelium (97), einsteiniu (99) și fermionii (100). Curiul (96), și californium (98) poate fi sintetizat (și, practic, obținut), în acest mod, dar acestea au fost inițial vizibile prin iradiere și plutoniu curiului particule alfa în accelerator. Elementele din mendeleviu grele (101) sunt obținute numai cu acceleratori, atunci când este iradiat cu ioni de lumină actinidelor ținte.
Dreptul de a propune un nume pentru un nou element chimic este dat descoperitorilor. Cu toate acestea, acest nume trebuie să respecte anumite reguli. Postează o nouă descoperire este verificată în câțiva ani de către laboratoare independente, și, dacă se confirmă, Uniunea Internațională de Chimie Pură și Aplicată (IUPAC, IUPAC, en: Uniunea Internațională pentru Chimie Pură și Aplicată) aprobă oficial numele noului element.
Elementele nedeschise sau neutverzhdonnye adesea se face referire la utilizarea sistemului utilizat mai Mendeleev, - titlul Omologul superioară în tabelul periodic, cu adaos de „eka-“ prefixele sau (rar) „mișcare“ înseamnă cifre sanscrita „unul“ și „doi“ ( în funcție de faptul dacă omologul este pentru 1 sau 2 perioade mai mari). De exemplu, înainte de deschiderea germaniu (în picioare, în tabelul periodic și sub siliciu prezis Mendeleev) numit-ECA ununoctiu siliciu (118) este de asemenea numit eka-radon. și fleurce (ununkvadiy, 114) - eka-lead.
Clasificare [ ]
Prevalența elementelor chimice din scoarța pământului (masa în%) este numărul
Educație [ ]
Majoritatea elementelor chimice (94 faimos 118) au fost găsite în natură (crusta), deși unele dintre acestea au fost pregătite inițial artificial (și anume, technețiu Tc (numărul de ordine 43), Pm prometiu (61), astatine La (85) și neptuniu transuranic Np (93) și plutoniu Pu (94), aceste cinci elemente după crearea artificială a fost în cantități vanishingly mici se găsesc în natură, ele apar ca intermediari în nucleu prin dezintegrarea radioactivă a uraniului și toriului, precum captarea de uraniu neutroni și decăderea beta ulterioară). Astfel, în crusta pământului există (în concentrații foarte diferite) toate primele 94 de elemente ale tabelului periodic.
Printre aceste 94 de elemente chimice găsite în crusta pământului, majoritatea (83) este primară sau primordială; acestea au apărut în timpul nucleosintezei din Galaxie înainte de formarea sistemului solar. iar aceste elemente au izotopi care sunt fie stabili, fie suficient de lungi pentru a nu se descompune în ultimii 4,567 miliarde de ani de acum. Restul de 11 elemente naturale (......... Tehnețiul, promețiu, poloniu astatine radon franciu radiu, actiniul protactiniu neptuniu și plutoniu) sunt radiogenică - ele nu sunt izotopi de lungă durată, astfel încât toți atomii naturali existenți ai acestor elemente în scoarța terestră are originea în radioactiv degradarea altor elemente [12] [13].
Toate elementele care urmează plutoniul Pu (numărul ordinal 94) în sistemul periodic al DI Mendeleev. în scoarța pământului sunt complet absente [14]. deși unele dintre ele pot fi formate în spațiu în timpul exploziilor supernova [sursa nu este specificată 1541 zile]. Timpii de înjumătățire ai tuturor izotopilor cunoscuți ai acestor elemente sunt mici în comparație cu timpul existenței Pământului. Mulți ani de căutări pentru elementele superioare de natură ipotetică nu au dat rezultate încă.
Majoritatea elementelor chimice, cu excepția câtorva foarte ușoare, a apărut în univers, în principal în timpul nucleosinteza stelare (elemente de fier - ca urmare a fuziunii, elemente mai grele - captarea secvențială de neutroni cu nuclee de atomi și ulterior beta-dezintegrare precum și în multe alte nuclear. reacţii). Cele mai ușoare elemente (hidrogen si heliu - aproape complet, litiu, beriliu și bor. - Part) formate în primele trei minute dupa Big Bang (nucleosinteză primar).
Una dintre principalele surse de elemente extrem de grele în univers ar trebui să fie, potrivit calculelor, fuziunea stelelor neutronice. cu eliberarea unor cantități semnificative din aceste elemente, care ulterior participă la formarea de noi stele și planetele lor. [15]
Elementele chimice ca parte integrantă a produselor chimice [ ]
Elementele chimice formează aproximativ 500 de substanțe simple [16]. Abilitatea unui element de a exista sub forma diferitelor substanțe simple care se deosebesc de proprietăți se numește alotropie. [16] În majoritatea cazurilor, numele substanțelor simple, coincid cu denumirea elementelor corespunzătoare (de exemplu, zinc, aluminiu, clor), cu toate acestea, în cazul existenței mai multor modificări alotropice denumirii substanței simple și elementul poate diferi, de exemplu, oxigenul (dioxigenați, O2) și ozon (O3 ); diamant. grafitul și un număr de alte modificări alotrope de carbon există împreună cu formele amorfe de carbon.