Instrumente și accesorii: cilindru metalic, manometru lichid, compresor.
Obiectiv: definiția experimentală a indicelui adiabatic
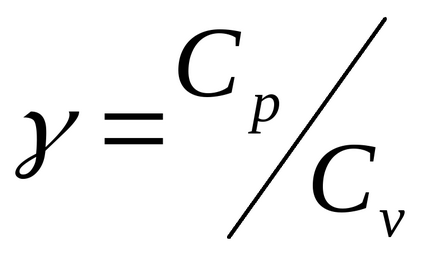
2.1. Partea teoretică
Pentru a caracteriza proprietatile termice ale unui gaz, ca orice alt corp, se foloseste o valoare speciala - capacitatea de caldura.
Capacitatea de căldură a unui corp este cantitatea de căldură care trebuie adusă sau scos din ea pentru a schimba temperatura cu 1 K:
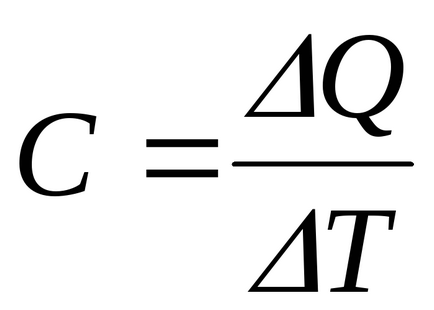
Căldura specifică pe unitate de masă a materiei se numește căldura specifică. Evident, nu caracterizează corpul, ci substanța din care este constituit acest corp. Capacitatea de căldură atribuită unui mol de materie se numește capacitatea de căldură molară.
Există o relație evidentă între căldura specifică și molecula C:
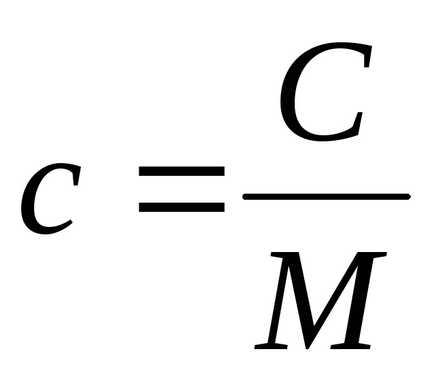
unde M este masa molară (măsurată în kg / mol).
Căldura specifică a unui gaz depinde de condițiile de încălzire. În particular, gazul poate fi încălzit la un volum constant V sau la o presiune constantă P. În consecință, obținem capacitatea de căldură pentru un volum constant Cv și căldura specifică la presiune constantă Cp.
Raportul Cp / Cv = γ este un parametru pentru procesele adiabatice și pentru procesele apropiate acestora (γ este numit coeficientul Poisson).
Procesul se numește adiabatic dacă în acest proces nu există schimb de căldură între gaz și mediul înconjurător (pereții vasului sunt izolați termic). Dacă procesul adiabatic este în echilibru (la fiecare moment de timp, presiunea P și temperatura T sunt aceleași în întregul volum), atunci este descrisă prin ecuația Poisson
Conform primei legi a termodinamicii
unde ΔQ este cantitatea de căldură, gazul raportat, ΔU este schimbarea energiei interne a gazului, ΔA este lucrarea efectuată de gaz asupra corpurilor externe.
Luați în considerare un mol de gaz. Dacă V = const. atunci ΔA = 0 și, în consecință, Cv = ΔU / ΔT. Dacă P = const. apoi ΔA = PΔV = RΔT. deoarece ecuația de stare (PV = RT) este valabilă în stările inițiale și finale ale gazului.
.
Astfel, capacitățile de căldură molară Cp și Cv pentru un gaz ideal sunt legate de relația
unde R este constanta gazului universal.
Cp> Cv. deoarece pentru V = const toată căldura care este transmisă gazului merge doar la schimbarea energiei interne a gazului, în timp ce la P = const că încălzirea gazului este inevitabil însoțită de expansiunea sa. În același timp, gazul funcționează, pentru care este necesar să-l informeze despre cantitatea suplimentară de căldură.
În teoria moleculare-cinetică a gazelor, se arată că
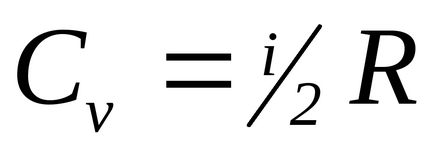
Pentru moleculele monatomice i = 3 (de exemplu, gaze inerte), pentru două molecule rigide atomice (distanța dintre molecule este constantă) i = 5.
Astfel de molecule sunt N2 și O2 în aer la temperatura camerei și, în consecință, pentru ele
.
2.2. Metodă pentru determinarea raportului Poisson
Luați în considerare un balon cu aer etanșat de un piston și conectat la un manometru în formă de U lichid (figura 2.1).
1. Lăsați inițial temperatura aerului din cilindru să fie egală cu temperatura camerei și presiunea depășește presiunea atmosferică cu o mică cantitate P '. Ecuația de stare a aerului în cilindru are forma
unde P este presiunea atmosferică; T este temperatura absolută a gazului, egală cu temperatura ambiantă; V este volumul ocupat de aer; P 'este presiunea suplimentară (determinată de manometru), m este masa aerului din cilindru, M este masa molară a aerului (un amestec de azot și oxigen).
2. Deplasați pistonul în sus. În același timp, aerul din cilindru se extinde și se răcește. Opriți pistonul (în poziția V2) în momentul în care presiunea din rezervor devine egală cu cea atmosferică (nivelurile lichidului din ambele genunchi ale ecartamentului sunt egale). În timpul expansiunii, gazul se angajează și se răcește.
După oprirea pistonului, aerul din cilindru este încălzit la temperatura camerei (datorită schimbului de căldură cu mediul înconjurător). în timp ce presiunea din cilindru crește cu o anumită cantitate P "(P" <Р'). Уравнение состояния воздуха в баллоне теперь имеет вид
Subliniem faptul că masa aerului din cilindru în stările 1 și 2 este aceeași.
3. În această lucrare, este esențial natura cilindru de aer de tranziție de la starea 1 la starea 2, și anume, în cazul în care expansiunea aerului are loc destul de rapid, schimbarea energiei sale interne este semnificativ mai mare decât energia care rămâne în urma timpului pentru a trece prin peretele cilindrului din mediul înconjurător , iar procesul de extindere poate fi considerat adiabatic. Dacă aerul în procesul de expansiune balon este un echilibru (presiune și temperatură sunt aceleași în întregul volum), atunci un astfel de procedeu este descris de ecuația Poisson: RVγ = const. Este clar că acest lucru este valabil doar pentru expansiunea lentă. Când ambele condiții sunt îndeplinite, ecuația Poisson este aplicabilă și, în consecință,
unde P este presiunea atmosferică.
și din (2.1) și (2.2) rezultă că
Comparând (2.4) și (2.5), obținem
Logaritmul (2.6), avem
Când P ' «P (în care P și“ «P) se poate folosi ln aproximare (1 + x) → x când x → 0. [Asigurați folosind calculatorul, că atunci când x ≤ 0,02 eroare la înlocuirea ln (1+ x) pentru x este mai mică de 1%. în această lucrare h ≈ 0,2 m. întrucât presiunea atmosferică corespunde unei înălțimii coloanei de apă de h ≈ 10 m].
Ca rezultat, obținem
deoarece P '= ρgh', P "= ρgh". Astfel, prin măsurarea h 'și h', putem găsi raportul lui Poisson γ.
2.3. Descrierea instalației
Setarea experimentală constă dintr-un cilindru metalic umplut cu aer, care este conectat la un manometru și la un compresor.
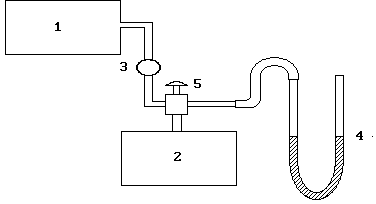
Fig. 2.2. Diagrama de instalare:
1 - compresor, 2 cilindri, 3 valve, 4 manometru în formă de U, 5 valve
2.4. Ordinea de executare a muncii
1. Cu compresor balonul umflat ușor în aer, astfel încât diferența de indicator de nivel de lichid a devenit egal cu 25-30 cm. Se închide ventilul pompa să aștepte 3-4 minute, până când temperatura aerului din cilindrul nu este egal cu camera (în timp ce mișcarea în nivelurile manometrice nu se oprește). La nivelul cel mai de jos al meniscului, determinați nivelul lichidelor L1 'și L2' în genunchii manometrului. Introduceți valorile L1 ', L2' și h '= L1' - L2 'din tabelul. 2.1.
2. Folosind o supapă, conectați rezervorul la atmosferă și mențineți-l deschis până când nivelurile din manometru sunt egale. În același timp, până la nivelare, fiecare nivel trebuie să se miște într-o direcție. Apoi închideți supapa. Aerul din cilindru se va încălzi până la temperatura camerei. În consecință, presiunea va crește. După 3-4 minute, când mișcarea nivelurilor din manometru se oprește, înregistrați valorile L1 ", L2" și h "= L1" -L2 "în Tabelul 2.1.
Notă. În realizarea acestui experiment, masa aerului din cilindru nu rămâne constantă. Dacă după pompare (starea 1) masa lui este m1. după deschiderea macaralei, o parte din aer părăsește cilindrul (starea 2), astfel încât masa aerului rămas în acesta m2 Este pentru m2 că toate cele de mai sus sunt adevărate atunci când derivă formula (2.8). Într-adevăr, în starea 1 masa m2 ocupă un anumit volum V1 Și în starea 2, masa m2 ocupă întregul volum al balonului (V2 = V. Fig.2.3). Astfel, pentru aerul de masă m2, stările 1 și 2 sunt descrise prin formulele (2.1) și respectiv (2.2), iar tranziția 1 → 2 prin formula (2.3). 3. Repetați experimentele de cel puțin 10 ori. Rezultatele măsurătorilor sunt prezentate în Tabelul. 2.1. 4. Din formula (2.8), calculați γ pentru fiecare experiment. 5. Calculați valoarea medie a lui γ. 6. Eroarea în definiția γ se calculează prin formula: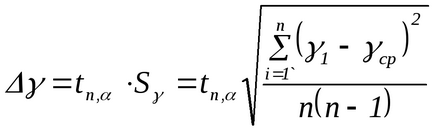
unde
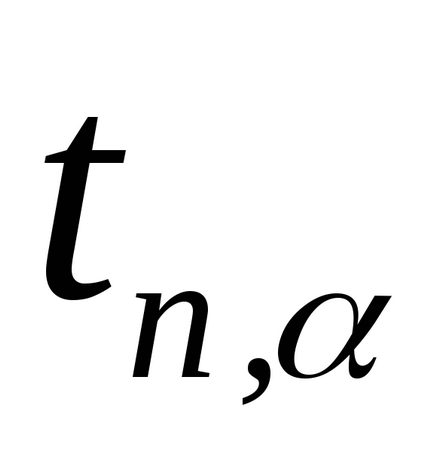
7. Comparați valoarea obținută γ = γσρ + Δγ cu valoarea teoretică a γ pentru un gaz diatomic.
Cum se determină căldura specifică și căldura specifică molară? Care este relația dintre ele? Unități de măsură.
Ce determină capacitatea de căldură a gazelor?
Care este raportul lui Poisson?
Ce proces se numește adiabatic și ce ecuație este descrisă?
Care este numărul de grade de libertate a unei molecule?
Care este valoarea teoretică a raportului aerian al lui Poisson?
Cum și de ce temperatura și presiunea aerului din sticlă se schimbă în timpul experimentului?
Ce efect are întârzierea asupra rezultatului atunci când supapa K1 este închisă?