În oxidarea biologică, doi atomi de hidrogen sunt separați de molecula organică sub acțiunea enzimei corespunzătoare. Într-o serie de cazuri, se formează o legătură instabilă, bogată în energie (macroscopică) între enzime și molecula oxidată. Acesta este folosit pentru a forma ATP - "scopul final" al majorității proceselor biologice de oxidare. Și doi atomi de hidrogen luați sunt rezultatul unei reacții asociate cu coenzima NAD (nicotinamidadenin dinucleotida) sau cu NADP (nicotinamidadenin dinucleotid fosfat).
Soarta ulterioară a hidrogenului poate fi diferită. La oxidarea anaerobă este transferată la unele molecule organice. În oxidarea aerobă, hidrogenul este transferat în oxigen pentru a forma apă. Partea principală a lanțului de transport al hidrogenului este localizată în membranele mitocondriilor. În același timp, ATP este format din ADP și fosfat anorganic.
Trebuie remarcat faptul că oxidarea aerobă este mult mai eficientă decât oxidarea anaerobă. În primul caz, 2 molecule de ATP formează de la o moleculă de glucoză, iar în al doilea - 36, unde glucoza este "arsă" la CO2 și apă. Aceasta explică evoluția răspândită și rapidă a organismelor aerobe.
Principala sursă de energie din celulă este oxidarea substraturilor cu oxigen în aer. Acest proces se desfășoară în trei moduri: adăugarea de oxigen la un atom de carbon, desprinderea hidrogenului sau pierderea unui electron. În celule, oxidarea are loc sub forma transportului succesiv de hidrogen și electroni de la substrat la oxigen. Oxigenul joacă rolul de compus reducător (oxidant) în acest caz. Reacțiile oxidative continuă cu eliberarea energiei. Pentru reacțiile biologice, schimbările relativ mici ale energiei sunt caracteristice. Acest lucru se realizează prin zdrobirea procesului de oxidare într-un număr de etape intermediare, care îi permite să fie depozitate în porții mici sub formă de compuși cu energie înaltă (ATP). Reducerea atomului de oxigen prin interacțiunea cu o pereche de protoni și electroni duce la formarea unei molecule de apă.
Respirația țesutului. Acesta este procesul de consumare a celulelor țesuturilor de oxigen, care este implicată în oxidarea biologică. Acest tip de oxidare se numește oxidare aerobă. Dacă acceptorul final în lanțul de transport al hidrogenului nu este oxigen, ci alte substanțe (de exemplu acidul piruvic), atunci acest tip de oxidare se numește anaerob.
astfel oxidarea biologică este dehidrogenarea substratului cu ajutorul purtătorilor intermediari de hidrogen și a acceptorului său final.
Lanțul respirator (enzimele de respirație tisulară) sunt purtătorii protonilor și electronilor din substratul oxidat până la oxigen. Agentul de oxidare este un compus capabil de a lua electroni. Această capacitate este caracterizată cantitativ printr-un potențial redox față de un electrod hidrogen standard al cărui pH este de 7,0. Cu cât potențialul de legare este mai scăzut, cu atât proprietățile sale de reducere sunt mai puternice și invers.
Astfel. orice compus poate da numai electroni unui compus cu un potențial de reducere a oxidării mai mare. În lanțul respirator, fiecare legătură ulterioară are un potențial mai mare decât cel precedent.
Lanțul respirator este format din:
1 dehidrogenază dependentă de NAD;
2 dehidrogenază dependentă de FAD;
3 Ubihinona (KoQ);
4 Citocrom b, c, a + a3.
Dehidrogenaze dependente de NAD. Deoarece coenzima conține NAD și NADPH. Inelul de piridină al nicotinamidei este capabil să atașeze electroni și protoni de hidrogen.
Dehidrogenazele dependente de FAD și FMN conțin ester fosforic al vitaminei B2 (FAD) ca coenzima.
Ubiquinona (CoQ) ia hidrogen din flavoproteine și se transformă în hidrochinonă.
Citocromii sunt proteine de cromoproteine care pot atașa electroni, datorită prezenței fero-firifrinelor în compoziția lor ca grupuri protetice. Ei iau un electron dintr-o substanță care este un reducător ușor mai puternic și îl transferă într-un oxidant mai puternic. Atomul de fier se leagă la atomul de azot al ciclului imidazol al aminoxilotului histidină pe o parte a planului ciclului porfirinic și, pe de altă parte, la atomul de sulf al metioninei. Prin urmare, capacitatea potențială a atomului de fier în citocromuri de a lega oxigenul este suprimată.
În citocrom, planul porfirinei este legat covalent de proteina prin două resturi de cisteină și în citocromii b și a. nu este legat covalent de proteine.
În citocromul a + a3 (citocrom oxidază), în locul protoporfirinei, este prezentă porfirina A, care este caracterizată printr-un număr de caracteristici structurale. A cincia poziție de coordonare a fierului este ocupată de o grupare amino care aparține restului de amino-zahăr care face parte din proteina în sine.
Spre deosebire de hemolgobina hem, atomul de fier din citocromii poate comuta reversibil de la două la o stare trivalentă, ceea ce asigură transportul electronilor.
Mecanismul lanțului de transport al electronilor. Membrana exterioară a mitocondriilor este permeabilă pentru majoritatea moleculelor mici și a ionilor, intern la aproape toți ionii (cu excepția protonilor H) și pentru cele mai multe molecule neîncărcate.
Procedeele de oxidare și formare a ATP din ADP și acid fosforic, adică fosforilarea apare în mitocondriile de pe membrana interioară - cristalele. O astfel de moleculă conține trei legături macroergice. Energia macroenergică sau bogată se numește o legătură chimică, când se rupe, se eliberează mai mult de 4 kcal / mol. Decuparea hidrolitică a ATP în ADP și acidul fosforic eliberează 7,3 kcal / mol. Exact același lucru este folosit pentru formarea ATP din ADP și a restului de acid fosforic și acesta este unul dintre principalele modalități de stocare a energiei în organism.
În timpul transportului de electroni prin lanțul respirator, se eliberează energie, care este folosită pentru atașarea reziduului de acid fosforic la ADP cu formarea unei molecule de ATP și o moleculă de apă. În timpul transferului unei perechi de electroni prin lanțul respirator, acesta este eliberat și depozitat sub forma a trei molecule ATP de 21,3 kcal / mol. Aceasta reprezintă aproximativ 40% din energia eliberată de transportul electronic.
Acest mod de stocare a energiei într-o celulă se numește fosforilare oxidativă sau fosforilare conjugată.
Rata fosforilării oxidative depinde în primul rând de conținutul ATP, cu cât consumul este mai rapid, cu cât se acumulează mai mult ADP, cu atât este mai mare nevoia de energie și, în consecință, procesul de fosforilare oxidativă. Reglarea ratei de fosforilare oxidativă prin concentrația în celulă a ADP se numește control respirator.
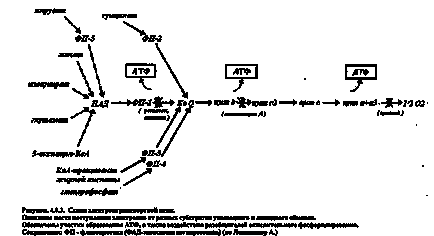
Figura 27 - Control respirator