Figura 2.3 - Dependența ratelor reacțiilor directe și inverse în timp τ. Atunci când aceste viteze sunt egale, se instalează echilibrul chimic.
Odată cu reacția, materiile prime sunt consumate și concentrațiile lor scad. În același timp, apar produsele de reacție, concentrațiile lor cresc. Ca urmare, începe o reacție inversă, iar rata sa crește treptat. Când ratele de reacții directe și inverse devin identice, echilibrul chimic se situează în. Este dinamic - spre deosebire de echilibrul static, care nu este însoțit de nici o mișcare. De exemplu, echilibrul mecanic al balanței este static. deoarece deși concentrațiile de substanțe din sistem rămân constante, reacția continuă să curgă atât în direcția înainte cât și înapoi.
Raportul dintre constantele de rată a reacțiilor înainte și înapoi (K) se numește constanta de echilibru. La o temperatură constantă, constanta de echilibru este o valoare constantă, indicând relația dintre concentrațiile produselor și substanțele inițiale, care se stabilește la echilibru. Valoarea lui K depinde de natura reactanților și de temperatura.
Sistemul se află într-o stare de echilibru atât timp cât condițiile externe sunt menținute constante. Cu o creștere a concentrației oricăror substanțe implicate în reacție, echilibrul este deplasat. Deplasarea echilibrului se datorează unei încălcări temporare a egalității ratelor reacțiilor directe și inverse. Dacă viteza reacției directe devine mai mare, atunci se spune că echilibrul se schimbă spre dreapta, dacă rata reacției inverse devine mai mare, atunci se consideră că echilibrul se schimbă spre stânga. După un timp, egalitatea vitezelor este din nou restaurată, adică vine o nouă stare de echilibru. față de consumul acestei substanțe; cu o scădere a concentrației oricărei substanțe, echilibrul se îndreaptă spre formarea acestei substanțe.
Atunci când gazele participă la reacție, echilibrul poate fi deranjat prin schimbarea presiunii:
Cu o presiune tot mai mare, de exemplu, de 2 ori concentrația fiecărui gaz va crește cu un factor de 2 și noile rate de reacție vor deveni egale cu vpr 'și vob'.
Schimbarea inegală a ratelor reacțiilor directe și inverse se datorează faptului că numărul moleculelor de gaz din părțile stângi și din dreapta ale ecuației de reacție este diferit. În acest sens, echilibrul cu presiunea tot mai mare se deplasează spre o scădere a numărului de molecule de gaz, adică în direcția scăderii presiunii.
Efectul temperaturii asupra constantei de echilibru. Efectul termic al reacției poate fi considerat ca fiind diferența dintre energiile de activare ale reacțiilor directe și inverse
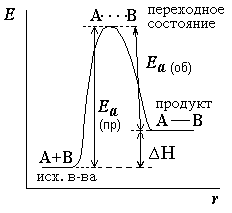
Diagrama energiei arată că efectul termic al reacției δH este într-adevăr egal cu diferența dintre aceste energii de activare.
δ H = Ea (np) - Ea (r). Pentru reacțiile endoterme, δH> 0; pentru reacții exotermice δH <0. Согласно уравнению Аррениуса *. зависимость константы равновесия от температуры можно выразить следующим образом:
Din ecuația relativă a constantei de echilibru la efectul termic δ H. rezultă că, pe măsură ce crește temperatura, are loc echilibrul reacției endoterme. Reacția endotermică are loc cu absorbția căldurii. mișcări spre dreapta și reacții exotermice. Reacția exotermă are loc cu eliberarea căldurii. - În stânga. De asemenea, se dovedește că catalizatorul * nu afectează constanta de echilibru, deoarece reduce energia de activare a reacțiilor înainte și înapoi cu aceeași cantitate.
Modelele care se manifestă în exemplele examinate sunt cazuri speciale ale unui principiu general. determinarea influenței diferiților factori asupra echilibrului sistemului. Acesta este principiul lui Le Chatelier: dacă sistemul este în echilibru, să aibă vreun efect, atunci, ca urmare a proceselor care apar în el, echilibrul se schimbă într-o astfel de direcție încât impactul va scădea.