Utilizarea polimixinelor în practica clinică nu se limitează la tratamentul infecțiilor sistemice. Datorită proprietății greu absorbit din tractul gastrointestinal (GIT), iar suprafața pielii și mucoaselor, sunt forme de dozare comune conținând polimixina B (sau alte polimixine), pentru aplicare topică pentru a trata infecții ale pielii și ale țesuturilor moi, infecții intestinale, boli oculare (conjunctivită, keratită), ureche externă și medie, cistită, empatie pleurală etc. În plus, cu ajutorul polimixinelor poate preveni eficient infectiile nosocomiale (NI), la pacienții care sunt în unitatea de terapie intensiva (ATI).
Ce este "decontaminarea selectivă a intestinului (KFOR)"?
decontaminarea selectiva a intestinului (SDK) - o metodă de profilaxie complexă a complicațiilor septice, având ca scop eliminarea bacteriilor patogene oportuniste din lumenul tractului gastrointestinal, care este principala sursă endogenă de infecție în cele mai diferite state. Metoda se bazează pe o combinație de antibiotice neresorbabile în tractul digestiv, componenta principala a care sunt polimixinelor (în particular polimixina B).
De fapt, KFOR filosofie se bazează pe conceptul de „purtător“ cele mai importante agenții patogeni, infecții nozocomiale care amenință pacientii UTI, precum și pentru punerea în aplicare efectivă a strategiei trebuie să se bazeze pe următoarele concepte [2]:
- baza de etiopatogeneză a HA constă într-un spectru limitat de potențiali agenți patogeni;
- Există trei căi patogenetice de răspândire a patogenului NI și, pentru a preveni în mod eficient dezvoltarea HI, este necesar să influențăm fiecare dintre ele.
Astfel, KFOR este o parte esențială a sistemului de prevenire, care include utilizarea antimicrobiană parenterală, enterală și topică.
Condițiile prealabile pentru utilizarea KFOR la pacienții din UTI
Aplicarea metodei SDC este asociată inseparabil cu astfel de concepte ca "purtător de microorganisme" și "colonizare".
Din definiția "transportului" în aspectul KFOR rezultă că aceasta este o condiție în care un pacient fără semne vizibile de infecție este izolat (la orice concentrație) de agenți patogeni potențiali din faringe și / sau rect pentru cel puțin o săptămână.
Colonizarea este prezența microorganismelor în zone anatomice, fluide biologice și țesuturi, care în mod normal ar trebui să fie sterile.
De obicei, izolat "sănătos" (original - «normală» - «normal") purtătoare, care este definită ca prezența continuă a uneia sau mai multora dintre următoarele 6 organisme: Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Escherichia coli și Candida albicans, și "patologic" purtătoare atunci când secretă una sau mai multe dintre următoarele nouă cauzative majore patogeni NO: Klebsiella, Proteus, Morganella, Citrobacter, Enterobacter, Serratia, Acinetobacter și Pseudomonas spp. si Staphylococcus aureus (MRSA).
- Astăzi transport sunt împărțite în funcție de gradul sau cantitatea de celule microbiene per 1 ml sau 1 g din conținutul (sau secrete) ZHKG: mare (≥105 agenți per 1 ml sau 1 g de conținut ZHKG) și grad scăzut (<105 возбудителей на 1 мл или 1 г содержимого ЖКГ) [3]. В первом случае чрезмерная микробная нагрузка приводит целому ряду неблагоприятных последствий, которые следует рассматривать как фон для развития НИ:
- creșterea excesivă a bacteriilor în lumenul tractului gastrointestinal este cauza imunosupresia: endotoxine gram (-) bacterii actioneaza asupra macrofagelor in peretele intestinal, care la rândul lor, să producă cantități excesive de citokine care intră în circulația sistemică, inhibă activitatea macrofagelor în intestin, plămân, ficat și peritoneu [4];
- citokinemia este una dintre legăturile principale în patogeneza răspunsului inflamator sistemic și a insuficienței multiple a organelor [5];
- creșterea excesivă a bacteriilor în derivațiile orofaringiene la colonizarea tractului respirator superior (inclusiv microaspiration cheltuieli, tulburările și clearance-ul traheal unele proceduri medicale) și translocația patogeni din intestin determină infecție hematogenă a țesutului pulmonar și a altor țesuturi și organe în mod normal steril;
- În cele din urmă, creșterea excesivă a bacteriilor în lumenul tractului gastrointestinal, în special în contextul terapiei cu antibiotice sistemice - acesta este cel mai important factor care determină selectarea tulpinilor rezistente de agenți patogeni care duc la formarea și răspândirea rezistenței la antibiotice in UTI [6-10].
Astfel, folosind KFOR, este posibil să se avertizeze:
- creșterea excesivă a agenților patogeni potențiali în tractul digestiv;
- eliberarea și absorbția intestinală a endotoxinelor de bacterii gram (-);
- cytokinemia;
- translocarea agenților patogeni prin peretele intestinal și bacteriemie;
- formarea rezistenței la antibiotice.
Ce este NI endogenă și exogenă?
Toate cazurile de NI pot fi împărțite, pornind de la etiologia bolii, și anume, sursa microorganismelor-agenți patogeni NI. Astfel, există:
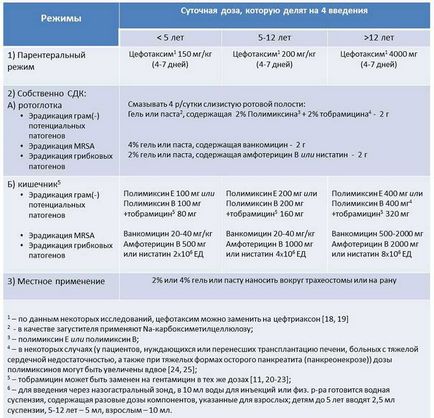
- endogen infecție primară, cele mai frecvente NI (55% din totalul NO), care se dezvoltă în prima săptămână de ședere a pacientului în ICU (sau o altă secție de spital); în etiologia infecțiilor endogene primare rol important pentru microorganisme, care sunt eliberate în timpul „sănătos“ și purtătorii de obicei acești agenți patogeni deja prezente în pacient (în orofaringe sau intestin) în momentul sosirii sale in UTI; Avertizare infecții endogene primare se bazează pe utilizarea de antibiotice parenterale cu spectru larg (standard este cefotaxim) pentru eradicarea agenților patogeni și a preveni purtător suplimentar. Cefotaxim este activ împotriva majorității agenților patogeni, definind „transport normal, și prin crearea unei concentrații bactericide în salivă și bilă, asigură eradicarea rapidă și completă a potențialilor agenți patogeni infecție endogenă primar. Pentru eradicarea agenților patogeni fungici, sunt propuse regimuri bazate pe polienii utilizați, incluzând amfotericina B și nistatina [10-12].
- Un al doilea NO endogen (aproximativ 30% din toate cazurile de orice ATI), dezvoltarea a doua săptămână de ședere pacientului în ICU, cauzând patogeni, determinarea transportului „patologic“. Aceste microorganisme intra în corpul pacientului după primirea acestuia într-un spital, iar selecția acestora are loc pe un fundal al terapiei (inclusiv antibacterian). Deoarece agenții patogeni orofaringiene și gastrointestinale sunt rezervoare, cea mai eficientă metodă de eradicare este SDK. Polimixina și aminoglicozid (tobramicina, gentamicina), formează baza KFOR, sunt activi împotriva tuturor agenților patogeni majori gram-negative aerobe bacteriene, NO endogen secundară (Klebsiella, Proteus, Morganella, Citrobacter, Enterobacter, Serratia, Acinetobacter spp și.); mai mult decât atât, aminoglicozide și polimixină prezintă activitate antimicrobiană sinergică împotriva Pseudomonas aeruginosa și alte Gram (-) agenți patogeni [13, 14]. In cazuri nefavorabile situație epidemiologică MRSA (de exemplu, în cazul în care un compartiment pentru o lună a avut cel puțin un caz verificat de infecție cauzate de MRSA) a recomandat o polimixină combinație + aminoglicozid adăugat vancomicină per os [15].
- Exogene NI (15% din toate NIs în ICU) cauzate de agenți patogeni care nu sunt niciodată eliberați din orofaringe și GIT ale pacientului. Infecțiile exogene nu se limitează la perioade de ședere în UTI și se pot dezvolta în orice moment după spitalizare. Cele mai importante măsuri preventive îndreptate spre prevenirea infecțiilor exogene este respectarea strictă a unei tehnici aseptice la efectuarea de proceduri invazive, care împiedică pătrunderea oricăror potențiale agenți patogeni inițial organe sterile și fluide ale corpului, precum și măsuri de igienă și utilizarea de antiseptice moderne. aplicarea topică eficientă a agenților antimicrobieni, inclusiv paste conținând polimixina B, aminoglicozide și vancomicina la pacienții cu traheostomie și tub nasogastric.
Implementarea strategiei KFOR în practică
Următoarele abordări privind prevenirea NI la pacienții din UTI au fost dezvoltate:
- toți pacienții care au nevoie de ventilatie artificiala (AV) pentru mai mult de 2 zile, cefotaxim demonstrat pentru eradicarea patogenilor alocate cu purtători „sănătoase“ de (Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus, Escherichia coli) orofaringian gastro-intestinale; durata rate parenteral - de la 4 până la 7 zile;
- pentru a preveni cele mai severe „endogen secundar“ NOR prezentat SDK în sine, bazat pe utilizarea de suspensii, paste și geluri cu antibiotice administrate în tractul digestiv, sau aplicate la nivelul mucoasei orale; decontaminare gel oral sau pasta se aplica la secțiunile inferioare ale suprafețelor interioare (mucoasa), obrajii și în părțile posterolateral ale gurii (cel mai simplu mod - aplicarea unei paste sau gel cu un deget înmănușat); pentru decontaminarea altor antibiotice suspensii apoase gastrointestinale sunt administrate printr-un tub nasogastric în stomac; Durata aplicării metodei KFOR variază de la 7 zile. sau mai mult, care este determinată în mod individual în funcție de greutatea pacientului, durata intubarea traheei și rezultatele cercetărilor microbiologice în dinamica bolii; absolut este prezentat KFOR deține pe toată perioada de intubare traheală și ventilație mecanică, dar, de asemenea, nu va fi de prisos să-l continue pe toată perioada de ședere a pacientului în ICU [26, 27];
- aplicarea topică a antisepticelor moderne și / sau gelurilor și pastelor cu antibiotice este indicată pentru prevenirea NI exogenă (vezi tabelul).
Pentru controlul eficacității KFD, este prezentată examinarea cultură a frotiurilor din mucoasa orală și rectală la momentul admiterii și ulterior la fiecare 3-4 zile.