masa molara de carbon
Greutatea unui mol de substanță se numește masa molară și M denotă o unitate principală de măsurare este masa molară g / mol (kg / kmol).
Orice compus chimic cu excepția greutății moleculare se caracterizează printr-o masă moleculară relativă. Greutatea moleculară relativă dl - este masa molară a compusului menționat la 1/12 din masa molară a atomului de carbon-12 (12C). Aceasta este o cantitate adimensionala.
Masa atomică relativă Ar - este masa molară a atomului de substanță, denumită 1/12 masa molară a atomului de carbon-12 (12C).
Masa atomica relativa a carbonului este 12.0116 uam Masa sa moleculară relativă este egală cu 12.0116 și masa molară:
M (C) = dl (C) x 1 = 12.0116 mol g / mol.
În condiții obișnuite de carbon (structura atomică prezentată în figura 1.) Pot exista sub forma de mai multe substanțe simple - modificări alotropice. Acestea sunt diamante și sistem cristalizat în hexagonal (lonsdalite) cubică și grafit, aparținând sistemului hexagonal. Toate au o masă molară egală cu 12.0116 g / mol. De asemenea, cunoscute sunt alte forme de carbon, cum ar fi cărbune, cocs, negru de fum, carbyne, polikumulen, grafit, fullerene, nanotuburile, nanofibre, etc. astralene
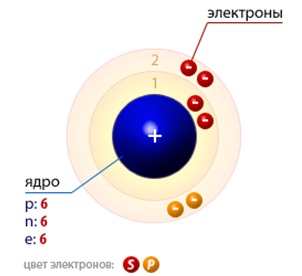
Fig. 1. Structura atomilor de carbon.
Carbon poate exista ca un gaz numai sub formă de substanțe solide, astfel încât, în scopul de a găsi valorile greutății moleculare nu se poate utiliza valoarea volumului molar, sau pentru a face calcule folosind formula Mendeleev-Clapeyron.
Exemple de rezolvare a problemelor
Termochimic ecuație arderea incompletă a carbonului este după cum urmează:
2C + O2 = 2CO + 220 kJ.
Se calculează cantitatea de căldură care este eliberată în timpul arderii carbonului cântărind 3 g
Este cunoscut faptul că reacția a luat 3 g de carbon. Se calculează greutatea materialului de pornire bazat pe ecuația reacției. Conform coeficienții stoechiometrici ai materialului de carbon este de 2 mol (n (C) = 2 mol). Gasim greutate carbon (masa molară este de 12 g / mol):
m (C) = n (C) x M (C);
m (C) = 2 x 12 = '24
Această ecuație reacției termochimice arată că arderea carbonului 24 g de 220 kJ de căldură este eliberată. Să presupunem pentru „x“ cantitatea de căldură care este eliberată în timpul arderii proporția de carbon și 3 g de scriere:
x = 3 x 220/24 = 27,5 kJ.
Când 3 g de combustie incompletă de carbon de 27,5 kJ de căldură eliberată.
În timpul arderii masei de cărbune 187,5 g de monoxid de carbon format (IV) volumul de 336 L (condiții normale). Se calculează fracțiunea de masă a carbonului în cărbune.
Reacțiile de combustie ecuația cărbunelui:
Am găsit cantitatea de substanță a oxidului de carbon (IV):
n (CO2) = 336 / 22,4 = 15 mol.
Conform n ecuația reacției (CO2) n (C) = 1: 1, adică n (CO2) = n (C) = 15 mol. Se calculează greutatea carbonului (masa molară este de 12 g / mol):
m (C) = n (C) x M (C);
m (C) = 15 x 12 = 180 g
Am găsit fracțiunea de masă a carbonului în cărbune:
w (C) = m (C) / mcoal × 100%;
ω (C) = 180 / 187,5 x 100% = 96%.