hidrogeni terțiar în nitrarea reacționează cel mai ușor cu primar - cel mai dificil. atomi de hidrogen secundari ocupă o poziție intermediară. Nitrarea are loc înainte de oxidare. Oxidarea are loc la locul de același atom de carbon, cu care există o grupă nitro. crește rata nitrare cu concentrația de acid azotic. dar, de asemenea, îmbunătățit procesul de oxidare. Temperaturile ridicate favorizează substituția la un atom primar. [C.303]
În cele din urmă, etan, care are doar hidrogeni primare. au reacționat la 220 °. Hidroperoxidul primar este descompus în apă și o aldehidă în care acesta din urmă este doar un intermediar [c.440]
Pentru atomii de hidrogen din coeficientul de reacție primar al frecvenței (acest raport este egal cu produsul factorului de probabilitate și factorul de viteză) este 9x1 = 9, deoarece factorul de viteză pentru atomii de hidrogen primar ma luat ca o unitate. Pentru raportul secundar frecvență atom de hidrogen este 2 X = 6,5 și 3,25 terțiar 1 X 4,43 = 4,43. Suma acestor factori este 19.9 3. Din acest [c.548]
Contactul dintre atomii de carbon primar întotdeauna mai puternic. decât C-C -bond în combinație cu primar, secundar (și terțiar C (ruptură C Energy) -C carbon. - carbon scade în ordinea următoare O> D> O> D> B> O [C.14]
Hidrocarburile atom H rezistența secundară de legare mai mică decât forța atomului principal de comunicare. Acest lucru este de acord cu randament ridicat de butii secundar radical, a cărui descompunere o mulțime de CH4 și SzNe. [C.304]
După cum clorurarea și nitrarea hidrocarburilor n-parafine. și atunci când acestea sunt formate toate sulfoclorurare teoretic posibile monosulfohloridy izomerică. Diferențele apar doar în înlocuirea izoparafinelor. In timp ce atomii de hidrogen terțiar. în special în locurile de ramificare. ușor clorurate, și în special nitril, atomii de hidrogen primari sau secundari la sulfohlo inert -rirovatsii. Astfel, cu sulfoclorurare izobutan format doar izobutan Sulfoclorura primar. În ceea ce privește butansulfohlorida terțiară, chiar și urme de ea nu poate fi obngt-o n. Acest lucru poate fi explicat doar prin efectul steric (obstacolul steric). [C.380]
Produsul principal al alchilării termic este 2,2-dimetilbutan. Cantitatea mai mică de 2-metilpentan este format ca urmare a unor reacții similare radicali izobutil formate prin abstractizare de hidrogen de la un atom de carbon primar în izobutan astfel de atomi de hidrogen fiind mai puțin reactivă încă mai numeroase decât atomi de hidrogen. legat de un atom de carbon terțiar. [C.232]
molecula izobutan are un primar și nouă atomi de hidrogen terțiar. în care atacul asupra atoy hidrogen terțiar conduce predominant la formarea de acetonă în clivaj rezultat ksilnogo peroxid radical meto dintr-un radical butii terțiar sau un radical metil-TION radicali butoxi terțiar [66]. Clivajul atom de hidrogen primar. care are loc. Desigur, cu cât este mai mare temperatura. conduce la formarea în principal acetaldehidă, formaldehidă și metil radicali în conformitate cu următoarea schemă de [c.338]
Luând substituție la o rată primară de 1 atom de carbon, iar în secundar - 3,25, probabilitatea de substituție a atomilor de hidrogen la șase atomi de carbon primar este 6 -1 = 6, iar cei doi atomi de hidrogen dintr-un atom de carbon secundar - = 2-3,25 6.50. Suma acestor valori este egală cu 6 + 6,50 = 12,50. [C.272]
De aceea, formarea ionilor de carboniu procedează cel mai ușor cu terțiari atomi de C, în timp ce cel mai ușor formate cu atomii carbion primar C [c.66]
Deoarece în moleculă-hexan până la 6 atomi de hidrogen legat de atomi de carbon primari și 8 - cu secundar, proporția [c.230]
Propap 6 conține atomi de hidrogen primari [c.427]
Acesta a fost mult timp căutând să identifice modele de atomii de hidrogen ai clorului din hidrocarburi parafinice. Astfel, aproape întotdeauna studiat clorinare hexan. derivate din petrol sau manitol de reducere, și heptan, extras din ulei sau ulei de Pinos Sabiniana. Inițial a crezut că atacurile de clor numai la sfârșitul moleculei de hidrocarburi. t. e. substituția are loc numai într-o grupare metil. Mai târziu a fost ferm stabilit că hidrogenul este înlocuit ca la al doilea atom de carbon. Posibilitatea de a considera educație și alte monohloralkanov, cu toate acestea, din moment ce nu au nici o confirmare experimentală a acestui punct de vedere a fost respinsă. Pe de altă parte, a crezut inițial că, în cazul produselor de substituție bromurare parafină la atomul de carbon primar nu este format, iar obținut exclusiv bromuri secundare. [C.533]
Aceasta implică faptul că un atom de hidrogen primar, o grupare metil este reacționat cu dehidroclorurare mai lent decât atomul de hidrogen secundar al grupării metilen. Dacă, dimpotrivă, este legat la atomul de carbon de halogen este între cele două grupe metilen (- H2 H I H2-), olefina poate fi format mai ușor decât atunci când gruparea ceteris paribus - H2 H I H3. În primul caz este un halogen pe atomii de carbon adiacenți egale în reactivitatea atomilor de hidrogen din grupările metilen în al doilea caz, deși există mai mulți atomi de hidrogen. care poate fi scindată, dar unul dintre atomii primari sunt mai puțin activi. [C.538]
Deoarece n-pentan are șase atomi primari și șase de hidrogen sunt secundare, ar fi de așteptat ca, în absența clorinare selective formate% primar 50 și clorură de n-amil secundar 50%. Cu toate acestea au fost obținute în mod indirect cifrele Ayrsa bazate pe compoziția procentuală a amestecului de alcooli amil. obținut prin hidroliza cloruri. [C.540]
Astfel, clorurarea parafinelor normale superioare a format un amestec echimolecular de toate posibile teoretic monohlorndov secundar, t. E. Substituent uniform distribuit în toate grupările metilen. Final Substituentul grupă metil includ o măsură mai mică decât în metilen, prin urmare, reactivitatea atomului de hidrogen primar redus. În cazul în care rata de substituție din nou atom de atomi de hidrogen primari și secundari sunt aproape la fel de 1 3. [c.553]
Digaloidalkily. Digaloidalkily, soderzhashih, s în moleculă, cel puțin. unul sau atom de carbon cuaternar. Acesta poate fi preparat prin condensarea cu digaloidalkilami de etilenă, în care cel puțin un atom de halogen este un atom de carbon terțiar în [20]. De exemplu, reacția 1,3-diclor-3-metilbutan (diclorhidrat de izopren) cu etilenă, în prezența A1S1d format 1,5-diclor-3,3-dimetilpentan. Este clar că un atom de clor. legat la un atom de carbon terțiar, foarte reactiv decât atomul de clor. scaun, la atomul de carbon primar iysya [c.231]
Urbanski și Elephant [74] a constatat că, atunci când oxizii de azot gaeofaznom nitrare parafinelor se obțin în principal nitroalcani primari, împreună cu cantități mici de O, O / -dinitroparafinov. În consecință, nitrarea au fost înlocuite primele hidrogeni primare. [C.561]
Izobutan. In alchilarea izobutanului cu etilenă (raport molar total de 3,5) la 505 ° C și o presiune de 316 atm a fost format din 135% în greutate. produs lichid. constând din 57% în greutate. hexan (25% din teoretic), din care circa 80% a fost de 2,2-dimetil [13]. Reziduul este 2-metilpentan cu un adaos mic de n-hexan. Această reacție a fost baza pentru producția industrială de neohexane [1]. 2,2-dimetil-2 predomină peste metilpsntanom deoarece atomii de hidrogen. Este la atomul de carbon terțiar, mai mobilă decât atomii de hidrogen din atomul de carbon primar. Pe de altă parte, acesta din urmă are nouă, în timp ce atomul de hidrogen. în picioare la terțiară C-atom este doar unul [c.307]
O dispoziție similară este de asemenea notat în cazul gazofaznogs nitrarea propan și n-butan, la 400 °, chiar și atunci când izomeri pot fi separați prin distilare. Când acest număr de izomeri format astfel încât raportul dintre rata de substituție a atomului de hidrogen de primar la secundar ca clorurare, egală cu 1 3,25. [C.573]
Deoarece radicalii propan atacă atât în poziția 1 și în poziția 2, atunci radicalii format C3H7 conțin ambii izomeri primari și secundari. (Atomii primar H ar trebui să formeze o perioadă de 3 ori mai mare, dar energia de separare primară a atomilor de hidrogen de aproximativ 3 kcal mai mare decât energia necesară pentru a detașa atomii de hidrogen secundari. Aceasta schimbă echilibrul spre reacția cu atomi de hidrogen secundari.) [C.414]
Încercările de a efectua reacția de schimb și terțiar etan menschu butilbrod1idom în prezență de bromură de aluminiu nu au avut succes, indicând faptul că eliminarea unui ion de hidrură de atomul de carbon primar este asociat cu dificultăți considerabile. [3] [C.218]
derivați de predominare pentena-1 datorită faptului că orice date de baze otschepls a șase protoni din doi atomi de carbon primar adiacent la un atom de carbon la un număr insuficient de electrozi este semnificativ mai ușor decât pierderea unuia dintre cei doi protoni ai atomului de metilen carbon al structurii neopentil, adică, po- aparent, acesta pierde protoni relativ dificil. [C.223]
In povzdenii unele parafinelor în prezența acidului sulfuric se observă poziția oarecum asemănător cu un caz de neopentan. Izomerizare cu acid sulfuric este discutat în detaliu mai jos. Este suficient să spunem că acidul sulfuric în condiții blânde în special predispuse doar să catalizeze astfel de reacții de izomerizare care pot fi privite ca schimbare de hidrogen intramoleculare între atomii de carbon terțiar, excluzând atomii secundari și primari. Produse Educație. obținute atunci când se aplică catalizatorilor ca clorura de aluminiu sau bromură. Acesta poate fi explicat în mod satisfăcător prin transferul intramoleculare de hidrogen între atomii terțiare și secundare, dar nu și carbon primar. Aici este un exemplu. În prezența acidului sulfuric este ușor de stabilit echilibru între 2- și 3-metilpentan, 2,2-dimetilbutan și offline, deși este termodinamic izomerul mai favorabil predomină și atunci când echilibrul este stabilit pe catalizator de clorură de aluminiu. [C.26]
Radicalii propilic generat, conform ecuațiilor (4) și (6), începând un nou ciclu de ecuații (3 și 5). Deoarece atomii de hidrogen. stând la atomii de carbon secundari, radicalii liberi detașat mai ușor decât atomii de hidrogen din atomii de carbon primari, ca intermediari vor fi formați radicali izopropil mai mare decât radicalii normali structura pronilnyh. și, prin urmare, produsele finale vor conține mai mult decât izopentanul n-pentan. Radicali izomerizării o etapă care precede transformarea acestora în hidrocarburi parafinice. dar se întâmplă. [C.306]
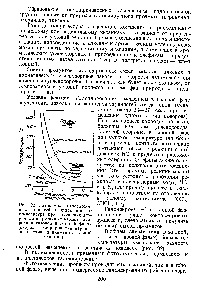
Metan și etan nu sunt aproape să reacționeze la 200 ° C și la 235 ° C CH4 reacționează de două ori mai repede decât SGBV. Neopentan schimbate mai repede decât propan și atomii de hidrogen din SzNz primar schimbate de șase ori mai repede decât secundar. Reactivitatea mai mare a atomilor de hidrogen este o trăsătură principală distinge clar aceste procese de catalizare pe metale. Mai mult decât atât, schimbul, de regulă, este o reacție fazică și produsul primar sunt -particle [22]. Următorul model bazat pe particule monoadsorbirovannyh, ajută la explicarea faptelor [c.73]
Prin ruperea heteropolar porțiunea karbanionopodobnaya C-H formează o legătură cu Cr. și N - cu 0 așa cum este indicat pentru adsorbția Ng (I.2.A Sec.). S-a arătat (secțiunea. I1.1), că acest tip de pauză curge mai ușor la atomii de carbon primari și atomii de carbon din inelul ciclopropan. [C.73]
Conform [32], cea mai mare sarcina negativa transporta atomi de carbon primar, apoi secundar și în final - terțiare. De exemplu, butena-1, densitatea de electroni este egal cu grupul CSI = -0.35, iar pentru gruparea = CH- este -0.035. Btenei 2 electroni densitate grup -SNz este -0.14--0.145 la. Prin urmare, este probabil ca adsorbția butenă-1 în formă cis se vor produce carboni C și C pe cei doi ioni A1 două extreme, pentru a forma un intermediar ciclic (denumit complex). Distanța dintre atomii de C și C este egal cu 0,274 nm și între ionii A1 este egal cu 0264 nm (ultima valoare găsită de la presupunerea că suprafața ideală este un plan uAOz 100 cubic ambalate aproape zăbrele unui spinel [33]). Pro-tofilny ion de oxigen va promova un transfer de protoni din poziția alilică - atomul de la C la C pentru a forma iis-2-butenă [c.155]