
Azotul subgrup este format din cinci elemente: azot, fosfor, arsenic, antimoniu și bismut. Acest p-V elemente ale tabelului periodic D. I. Mendeleeva.
Nivelul de energie exterior al atomilor acestor elemente conțin cinci electroni care au ns2np3 configurație și distribuite după cum urmează:
Prin urmare, cu cât gradul de oxidare a acestor elemente 5, o mai mică -3 și +3 caracteristică.
Prezența a trei electroni nepereche în nivelul exterior indică faptul că, în elementele de stat undriven au atomi valența 3. Stratul exterior al atomilor de azot este format din doar două subnivele - 2s și 2p. Atomii elementelor rămase ale subgrupului pe nivelele de energie exterioare sunt celulă vacante d-sub. Prin urmare, unul dintre nivelele exterioare ale s-electroni se pot deplasa la excitat atunci când d-subnivel la același nivel, ceea ce conduce la formarea de 5 electroni nepereche.
învelișul de electroni exterior al fosforului (atom neexcitat)
coajă de electroni exterior al atomului de fosfor excitat.
Astfel, fosfor, arsenic, antimoniu și bismut în stare excitată au cinci electroni nepereche în valența lor, iar această stare este egală cu 5.
Atomul de azot pentru a excita un electron în acest mod nu poate fi din cauza lipsei de d-subnivel pe al doilea nivel. Prin urmare, azotul pentavalent nu poate fi, totuși, poate forma o legătură covalentă cu un al patrulea mecanism donor-acceptor datorită lone 2s2 pereche de electroni. La un atom de azot și eventual un alt proces. Când unul dintre azotul 2s-electron două izolare intră individual încărcat tetravalent ion N +.
Atomii de azot de bismut creștere raze și scad potențialele de ionizare. Proprietățile Reducerea atomilor neutri sunt amplificate de N la Bi și slabeste oxidare (vezi. Tabelul. 21).
Cu hidrogen, azot, fosfor și arsen formă RH3 compus polar care arată starea de oxidare negativă -3. Moleculele RH3 au o formă piramidală. În acești compuși, elementele de cuplare cu hidrogen mai durabile decât compușii de oxigen corespunzătoare ale elementelor subgrupul și subgrupe în special halogen. De aceea, compusul de hidrogen a elementelor subgrupului de azot în soluții apoase, nu formează ioni de hidrogen.
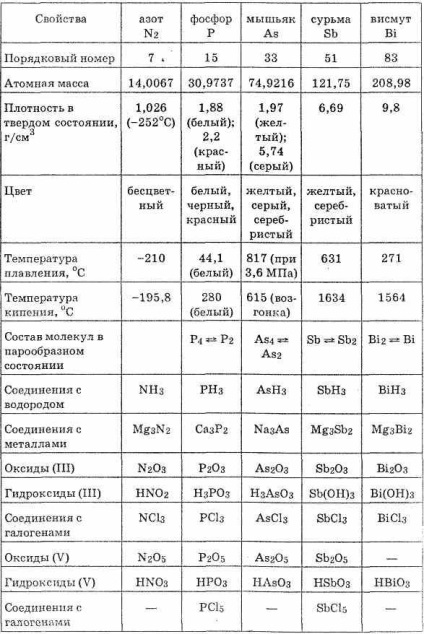
Azot cu oxizi sub formă de oxigen din elementele subgrupei cu formula generală R2O3 și R2O5. Oxizii corespund acidului HRO2 și HRO3 (și H3RO4 orthoacid, cu excepția azotului). În cadrul subgrupei oxizi de caractere se schimbă, astfel: N2O3 - oxid acid; R4O6 - oxid slab acid; As2O3 - oxid amfoter cu o predominanță a proprietăților acide; Sb2O3 - oxid amfoter cu o predominanță a proprietăților de bază; Bi2O3 - oxid de bază. Astfel, proprietățile acide ale R2O3 și compoziția R2O5 oxizilor sunt reduse cu creșterea numărului ordinal al elementului.
După cum se vede din tabelul. 21, într-un subgrup de azot de bismut proprietăți metalice scad și creșterea metalului. Noi antimoniu aceste proprietăți sunt aceleași, dominată de bismut metalici, azot - proprietăți nemetalice. Fosforul, forma antimoniu mai mulți compuși alotropic arsenic și.
In laboratoare poate fi produs prin reacția de descompunere a nitritului de amoniu:
Reacția este exotermă, merge pentru a elibera 80 kcal (335 kJ) și, prin urmare, necesită răcirea vasului în timpul curgerii sale (deși nitrit de încălzire amoniu necesar pentru a iniția reacția).
Practic, această reacție se realizează prin adăugarea în picături, o soluție saturată de nitrit de sodiu într-o soluție saturată de sulfat de amoniu încălzit, cu rezultat din reacția este descompusa instantaneu nitrit de amoniu.
Gazul scapă este contaminat cu amoniac, oxid nitric (I) și oxigen, din care a fost purificat prin trecerea secvențială prin soluții de acid sulfuric, sulfat de fier (II) și un roșu-fierbinte peste cupru. Apoi, uscat azot.
O altă metodă de laborator pentru producerea azotului - încălzirea unui amestec de bicromat de potasiu și sulfat de amoniu (în raportul 2: 1 în greutate). Reacția are loc conform ecuațiilor:
Azotul mai pur poate fi obținut prin descompunerea azide metalice:
Așa-numitele „aer“ sau „ambiant“ azot, adică un amestec de gaze de azot și nobile, preparate prin reacția aerului cu cocsul înroșit, formând o așa-numită „regenerare“ sau „aer“ gaz - materii prime pentru sinteze chimice și combustibili . Dacă este necesar, acesta poate fi izolat de azot, monoxid de carbon absorbit.
azot molecular în industrie a fost preparată prin distilarea fracționată a aerului lichid. pot fi obținute prin această metodă și „azotul atmosferic.“ De asemenea, este utilizat pe scară largă plante de azot, care utilizează metoda de separare a gazelor de adsorbție și membrană.
Metode Un laborator - trecerea de amoniac peste oxid de cupru (II) la o temperatură
Amoniacul este luat din soluția saturată cu încălzire. CuO, suma este de 2 ori mai mult decât de decontare. Imediat înainte de utilizare azot purificat de oxigen impurități și amoniac prin trecerea peste cupru și un oxid al acestuia (II) (de asemenea,
700 ° C), apoi se usucă cu acid sulfuric concentrat și uscat alcalin. Procesul este destul de lent, dar merita: gazul se dovedește foarte curat.