Suntem interesați în piața medie a vitezei de proiecție. Este la fel ca și modulul vitezei la pătrat (a se vedea expresia (4.1.2).)
Moleculele viteză ia gamă continuă de valori. Se determină valorile exacte ale vitezei și pentru a calcula valoarea medie (medie statistică) folosind Formula (4.3.2) este practic imposibil. defini
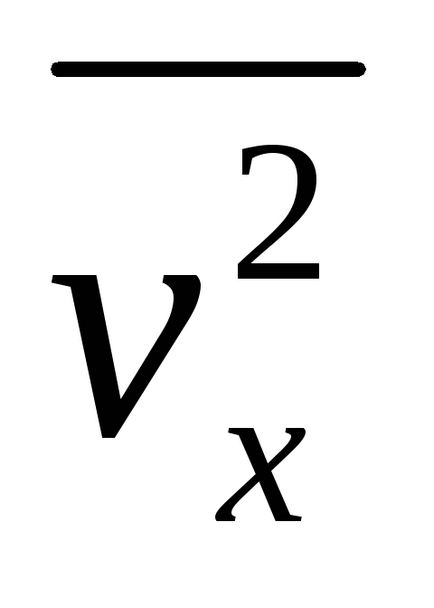
* Pentru informații cu privire la modul în care pot fi determinate aceste numere, acesta va fi discutat în §4.6.
Deoarece direcția X este același ca și Y și Z se înregistrează (din nou, din cauza haosului din mișcarea moleculelor), egalitati:
Pentru pătratul vitezei fiecărei molecule este egal cu:
(. Vezi Formula (4.3.2) și (4.3.3)) Valoarea vitezei pătratică medie, determinată ca și viteza medie pătrată a proiecției este suma pătratelor proiecțiilor sale secundare:
Din expresiile (4.3.4) și (4.3.5) rezultă că
T. E. Sredny proiecția vitezei pătrat este
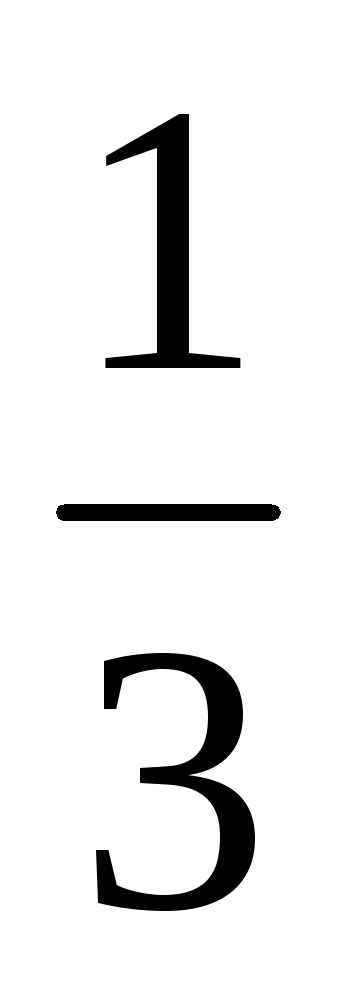
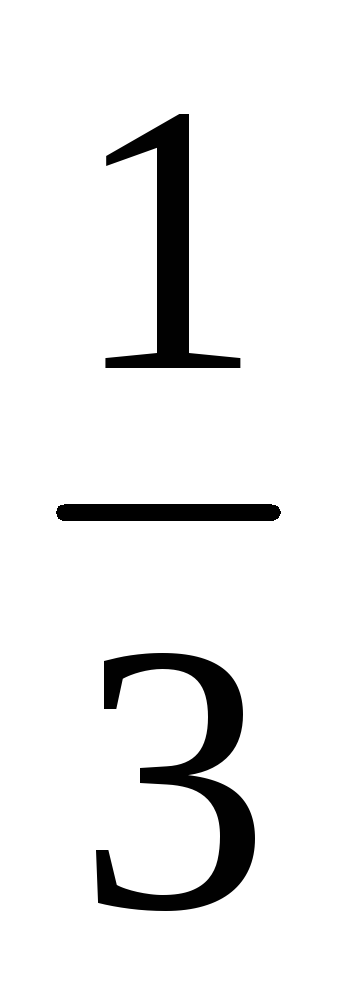
Moleculele de viteză variază în mod aleatoriu, dar valoarea medie a proiecției vitezei pentru orice direcție și viteza medie pătrată - valoare definită.
§ 4.4. Ecuația fundamentală a teoriei moleculare cinetice
Calculăm prin teoria cinetică moleculară a presiunii gazului. Pe baza calculelor efectuate se poate face o concluzie foarte importantă cu privire la temperatura gazului din cauza energiei cinetice medii a moleculelor.
Să presupunem că gazul este într-un recipient dreptunghiular cu pereți solizi. Gaze și vas au aceeași temperatură, t. E. Sunt într-o stare de echilibru termic. Presupunem coliziunii moleculare cu pereții complet elastice. În aceste condiții, energia cinetică a moleculelor într-o coliziune nu se schimba.
Cerința ca ciocnirile erau absolut elastice, nu este strict necesar. Exact acesta nu este pus în aplicare. Molecule pot fi reflectate de pereții de la unghiuri diferite și la viteze care nu sunt viteze modulo egale înainte de coliziune. Dar energia cinetică medie a moleculelor de perete reflectate va fi egală cu energia cinetică a moleculelor incidente, dacă nu există echilibru termic. Rezultatele de calcul nu depind de o imagine detaliată a moleculelor cu ciocnirile de perete. Prin urmare, este permis să ia în considerare moleculele de coliziune astfel de coliziuni bile elastice cu perete solid perfect netedă.
Calculăm presiunea gazului pe peretele recipientului CD având o suprafață S și perpendicular pe axa X (fig. 4.3).