Distinge 4 tipuri elektrokin ?? fenomene eticheskih: electroforeză, electroosmoza, potențialul de curgere (debitul), potențialul de sedimentare (OS ?? edaniya).
Sub influența unui câmp electric extern se observă două fenomene:
1. Deplasarea fazei dispersate în raport cu mediul de dispersie fixă - electroforeză.
2. Mediul de dispersie se deplasează în raport cu faza dispersată staționară - electroosmoza.
Phenomenon, revers electroforeză și electroosmoza.
1. Apariția potențială diferență atunci când se deplasează în fază dispersată în raport cu mediul de dispersie fixă - potențialul de sedimentare (?? axele edaniya).
2. Apariția unei diferențe de potențial atunci când se deplasează în raport cu mediul de dispersie fixă a fazei dispersate - potențiale scurgeri.
Motivul elektrokin ?? eticheskih fenomene este formarea stratului dublu electric, și ca urmare, prezența sarcinii electrice deoarece particulele fazei dispersate și mediul de dispersie de particule.
Valoarea electroforezei, electroosmoza
Electroforeza este utilizat in studiile clinice pentru diagnosticul multor boli pentru partitie ?? Eniya aminoacizi, acizi nucleici, antibiotice, enzime, celule sanguine, a fost determinat pentru ?? Eniya preparatele proteice de puritate pentru administrarea medicamentelor.
In plus fata medical ?? e electroforezei este utilizată pentru administrarea medicamentelor. Aplicată la tamponul de piele umezită cu o soluție a unui medicament preparata͵ și electrozii de top la care se aplică un nivel scăzut, în condiții de siguranță pentru potențialul corp. Particulele de medicament prin acțiunea câmpului electric în țesuturi în mișcare.
Electroosmoza este folosit pentru deshidratarea diferitelor materiale poroase. Masa umedă este plasată între electrozi și apă, sub influența unui câmp electric bazat pe structura EDL este mutat la unul dintre electrozi și se colectează într-un recipient special.
Electroforeza Viteza (activitatea electroforetic) se calculează din ecuația Helmholtz-Smoluchowski:

U - electroforeză viteză (mobilitate electroforetică)
# 949; - constanta dielectrică a mediului
# 958; - elektrokin potențial etichesky ??
H - intensitatea câmpului electric
# 951; - vâscozitatea mediului
Puterea câmpului electric este exprimată prin raportul dintre diferența de potențial și distanța dintre electrozi:


Stabilitatea sistemelor disperse
Prin stabilitatea dispersiei să înțeleagă capacitatea sa de a păstra timp
- dimensiunea medie a particulelor
- acestea sunt uniform distribuite în mediul IX ??
Pentru sistemele disperse sunt două tipuri de stabilitate - kin ?? eticheskuyu (sedimentare) și agregate.
Kin ?? eticheskaya (sedimentare) caracterizează capacitatea stabilității particulelor fazei disperse rămân în suspensie și nu edat ?? axele sub acțiunea gravitației.
Stabilitatea agregată caracterizează capacitatea particulelor fazei dispersate contracara adeziunea între ele și păstra astfel dimensiunea lor neschimbată.
soluțiile coloidale de stabilitate într-o poziție intermediară între sistemele grosiere și soluții adevărate. soluțiile coloidale de obicei, de la sebyasedimentatsionno sisteme stabile. datorat
1. Dimensiunea mică a particulelor
2. mișcarea lor browniană intensă
Pentru a cumula factorii de stabilitate includ următoarele:
1. Prezența particulelor de sarcină electrică le împiedică să se lipească împreună
2. Capacitatea de a solvatului stratul counterion difuz; produsă pe suprafața particulei straturilor protectoare de contraioni solvatați, de asemenea, îi împiedică să se lipească între ele
3. Adsorbția agentului tensioactiv pe suprafața substanțelor (surfactanți); în jurul „capete hidrofile“ orientează apa dipolilor surfactant format ca rezultat al stratului prevenind lipirea adsorbției solvat. Acest fenomen se numește - „coloid de protecție“
4. viscozitatea mediului: cu cât vâscozitatea este, viteza mai mică a particulelor este mai mică oportunitate de coliziune și de sedimentare.
Violarea stabilității sistemelor disperse conduce la apariția coagulării și sedimentării ulterioară a particulelor dispersate.
procesul de coagulare numit adeziunea particulelor coloidale pentru a forma agregate mai mari din cauza pierderii stabilității agregare coloid.
Coagularea poate provoca o varietate de factori externi:
1. Adăugarea unor mici cantități de electrolit
2. concentrația soluției coloidale
3. Modificarea temperaturii
4. Efectul ultrasunete
5. Efectul câmpului electromagnetic
6. agitare, agitare, etc.
În sistemele biologice, cea mai mare importanță practică este coagularea electroliți, ca soluții coloidale de celule si fluide biologice sunt în contact cu electroliți.
Pentru fiecare electrolit are nevoie de propria sa concentrație minimă numită prag de coagulare sau de prag de concentrație (FBS).
Inversul pragului de coagulare, denumit în continuare capacitatea de coagulare:

Următoarele reguli electroliți de coagulare:
1. ionii de coagulare cauze care au un semn de sarcină opusă acuzației de pelete. Coagularea încărcate pozitiv coloizi provoca anioni, cationi cu sarcină negativă -.
2. Efectul coagulant al ionilor, cu atât mai puternic cu cât sarcina ionului - coagulant (regula Schulze-Hardy)


3. Pentru ionii de aceeași capacitate de încărcare coagulant depinde de raza ionului solvatat: cu cât raza, mai mică capacitatea de coagulare.
În consecință, pentru cationii metalelor alcaline pot fi scrise urmatoarea serie liotropic:


Mecanismele de coagulare rol de electrolit constă în principal în faptul că:
1. Reducerea poate avea loc sarcină de suprafață a fazei solide (încărcătura de suprafață a nucleelor), ᴛ.ᴇ. prin reducerea interfaciale (elektrotermodinamicheskogo) clădirea E.
2. reducerea grosimii stratului de difuzie poate avea loc la o constantă nuclee de încărcare de suprafață.
În acest sens, există următoarea teorie de coagulare:
1. adsorbție (chimic) Teoria Freundlich
2. Teoria fizică a coagulării DLVO (B. V. Deryagina, Landau, E. Verwey, T. J. Overbeck.)
1. Conform teoriei lui Freundlich coagularea are loc sub acțiunea elektrolita͵ care interacționează chimic cu potențial determinare a ionilor, legându-le ferm conectat ?? ix (de exemplu, traducerea unui precipitat).
Astfel, în plus față de iodura de argint sulfurii sol AgI potasiu încărcat pozitiv coagulante K2 S între S 2- anioni și cationi potențial Ag + reacție are loc: 2AG + + S 2- → AG2 S ↓. Ca urmare, valoarea potențială interfacială scade, numărul de ioni contra necesare pentru a compensa taxa nucleelor este, de asemenea, redusă, și, în consecință redusă și cojile de hidratare din jurul ionilor, ceea ce duce la adeziunea particulelor, ᴛ.ᴇ. coagulare. Cu toate acestea, a redus cantitățile de capacitate interfacială și implică o scădere # 958; -potential, ᴛ.ᴇ. Reducerea responsabilă de particule, având ca rezultat o scădere a rezistenței, ᴛ.ᴇ. coagulare.
2. În conformitate cu teoria DLVO, de coagulare se produce sub acțiunea elektrolita͵ care nu reacționează chimic cu IRP și nu modifică taxa nucleară.
În acest caz, exponatul acțiunea de coagulare a acestor ioni, care sunt adăugate contraionilor elektrolita͵ date micelare.
Creșterea concentrației electrolitului scade stratul de difuzie. potențial interfacială, cu toate acestea, rămâne neschimbată, dar există o reducere # 958; -potential.
De exemplu: adăugarea de nitrat de la coloidală, încărcat pozitiv iodură de argint, AgI, care miceliile cuprind contraioni NO3 -

Deoarece concentrația ionilor adăugat NO3 - acestea facilitează introducerea stratului counterion difuz în stratul de adsorbție. Strat de difuzie este comprimat și se poate produce o stare în care MECs strat difuz ?? dispare și devine o granulă electric, ᴛ.ᴇ. acesta va fi în stare izoelectrică.
stare izoelectrică se numește o stare de particule coloidale, în care elektrokin ?? etichesky potențial (# 958) este egal cu 0 și, ĸᴏᴛᴏᴩᴏᴇ peleți direcțională caracterizată prin absența mișcării într-un câmp electric.
Valoarea stare-agregare constantă a soluției coloidale # 958; -potential este în intervalul de 50-70 mV. Cu o scădere # 958; -potential de electrolit la 25-30 mV în sistem există vreo schimbare externă (turbiditatii sau o schimbare de culoare), deoarece rata de coagulare este foarte scăzută, astfel încât această etapă (I) este de obicei numit „latent“ coagulare (orez) .
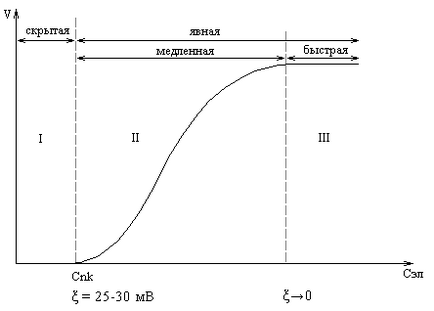
Fig. Efectul concentrației de electrolit asupra ratei de coagulare
Adăugarea suplimentară de electrolit (> CNN) este însoțită de o opacizare a soluției și începe „explicit“ coagulare. Inițial, rata de coagulare este crescut rapid (etapa II), și apoi devine constantă atunci când valoarea # 958; -potential devine egal cu 0 și vin pas rapid de coagulare (III).
Coagularea prin amestecuri de electroliți
Există 3 opțiuni posibile pentru interacțiunea dintre electroliți: un efect aditiv, și blues antagonism ?? ergizm.
Aditivitate - însumării ϶ᴛᴏ coaguleze acțiune a ionilor, care cauzează coagulare.
Un efect aditiv este observat în acele cazuri în care electroliții care conțin ioni de coagulante, nu reacționează chimic unul cu celălalt.
De exemplu, un amestec de săruri de KCl, NaNO3 prezintă un efect aditiv în ceea ce privește atât soluțiile coloidale încărcate negativ (coagulare cauza K + Na +.), Și coloizilor încărcați pozitiv (cauza de coagulare Cl -. NO3 -).
Antagonismul - ϶ᴛᴏ slăbirea acțiunii coagulant a electrolitului în prezența celuilalt.
Antagonismul se manifestă în cazul în care o reacție chimică între electroliți coagulante ionii sunt legați forma insolubila conectat ?? Depunerea (precipitat) sau într-un complex durabil, care nu are nici o putere coagulante.
De exemplu, acțiunea de coagulare Pb 2+ cationi la coloizilor adverse atenuate în prezența NaCl, după cum reacția are loc
Pb 2+ + 2CI - = PbCI2 ↓
Sin ?? ergizm - amplificarea ϶ᴛᴏ coagulante acțiunea electrolitului în prezența celuilalt.
Sin ?? ergizm posibil, dacă există o interacțiune chimică, având ca rezultat formarea unui dintre electroliți de ioni cu sarcină multiplă.
De exemplu, FeCl3 acțiune de coagulare și KCNS către coloizi pozitivi (coagulante ionii Cl -. CNS -) este îmbunătățită, deoarece reacția are loc
și formarea ionilor [Fe (CNS) 6] 3-. având o mare putere coagulant.
Utilizarea electroliților în medical ?? e, este esențial să se ia în considerare posibilitatea de coagulare în probe biologice, ca, de exemplu, introducerea de diferite medicamente pentru a organismului prin injecție ar trebui să știe dacă aceste substanțe de sinteză ?? ergistami, pentru a evita posibila coagulare.
Heterocoagulation numit de coagulare a soluțiilor coloidale care conțin particule eterogene, care diferă în natură chimică, sau o valoare semn ?? mii taxa.
Un caz particular este heterocoagulation coagulare mutuală - coalescența particulelor coloidale încărcate opus. Atunci când acest lucru se produce coagularea mai complet, cu atât mai mult se neutralizează complet de sarcinile particulelor coloidale (granule taxe).
Peptization numitul proces invers de coagulare - procesul de conversie a nămolului format prin coagularea intr-o soluție coloidală stabilă.
Peptization în practică, realizată în două moduri:
1. Spălarea precipitatului cu pur cm solvent ?? (mediu de dispersie), ceea ce conduce la scurgerea de ioni, provocând coagulare.
2. Adăugarea de electrolit special - peptizer, ionii care sunt adsorbite pe suprafața particulei este redusă atmosferă ionică în jurul particulelor.
Condițiile necesare pentru peptization:
1. Prin peptization poate doar proaspăt precipitații, deoarece depozitare lung duce la o particule de coalescență precipita la compactare treptată și deplasarea acesteia din structura sa de fază lichidă.
2. Adăugarea unor mici cantități de electrolit (altfel se produce coagulare)
Soluție 3. AMESTECARE
Protecția Coloidal numit creșterea stabilității agregatelor lyophobic coloizi prin adăugarea la acesta bleumarin.
Mecanismul de acțiune de protecție constă în principal în faptul că, în soluțiile apoase ale DIU molecule amfifile coloidal adsorbit pe suprafața particulelor coloidale sunt orientate astfel încât porțiunile lor hidrofobe, care se confruntă cu particulele de fază dispersată, hidrofil - apă. Ca rezultat, suprafața particulei devine acoperit cu înveliș solvatare liofilizați și suplimentare.
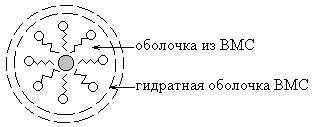
În ceea ce privește soluțiile coloidale apoase posedă o acțiune bună de protecție a proteinelor solubile în apă. Astfel, proteinele din sânge inhibă precipitarea colesterolului recuperat și ?? eniyu pe pereții vaselor de sânge și săruri de calciu.
Protecția coloidal este utilizat în prepararea coloizi lyophobic stabile utili ca produse farmaceutice. De exemplu, un argint coloid și Protargolum conțin eniyami foarte dispersă argint metalic, macromolecular protejat conectat ??.
a se vedea, de asemenea,
Luând în considerare structura miceliilor sa demonstrat că un strat dublu electric format pe suprafața coloizilor lyophobic. Prima teorie a structurii DES a fost dezvoltat de Helmholtz și Perrin; în reprezentarea lor a condensatorului electric dublu strat asemănător plat. [Citește mai mult].
O fază dispersată în soluțiile coloidale sunt particule cu structură complexă. Acestea se numesc - micele. Coloizii Lyophobic necesită în mod necesar prezența electrolitului stabilizator special. ionii stabilizatoare sunt adsorbite pe particule. [Citește mai mult].