4.1. legătură covalentă
Atunci când se analizează natura legăturii covalente sunt folosite acum două abordări: metoda de legături de valență (MBC), cât și metoda orbitali moleculare (OMI).
MFR se presupune că comunicațiile se realizează între atomii din cadrul de ansamblu de perechi de electroni camp in ambele nuclee. Formarea unei perechi de electroni este posibilă datorită suprapunerii norilor de electroni de spin opus.
Distinge mecanism de schimb și donor-acceptor de formare a legăturii covalente.
1) Mecanismul de schimb. Fiecare atom dă un electron nepereche în perechea de electroni totală:
2) Mecanismul Donor-acceptor. Un atom (donor) oferă o pereche de electroni, iar celălalt atom (acceptor) prevede această pereche de liberă orbitale;
Doi atomi pot socializa perechi de electroni neckolko. Numărul de perechi de electroni, care leagă doi atomi se numește multiplicitatea relației dintre acești atomi. Simplă conexiune (obișnuit) corespunde unei perechi de electroni comune, dublă sau triplă legătură - respectiv, două sau trei perechi de electroni comune.
Dacă densitatea de electroni este situată simetric între atomii, o legătură covalentă este numit nepolară. Dacă densitatea de electroni este deplasat spre unul dintre atomii, legătura covalentă se numește polar. Cu cât mai mare polaritatea conexiunii, cu atât mai mare diferența în electronegativities de atomi.
Electronegativitate - este capacitatea unui atom de a atrage electroni din altă densitate de atomi. Cele mai electronegative elemente - fluor, cel mai electropozitiv - Franța.
Legătura covalentă este direcțională, saturability și polarizabilitatea.
Saturația rezultă din faptul că covalency atomului nu poate fi arbitrar de mare. Acesta este determinat de numărul de electroni nepereche în stratul de valență, aproape de ele pe energia electronilor de perechi de electroni neîmpărtășite și orbitali vacante.
Directivitate legătură covalentă determinată de necesitatea de suprapunere maximă în spațiul norilor de electroni ai atomilor care interacționează, ceea ce conduce la formarea celor mai puternice obligațiuni.
În funcție de geometria suprapunerii norilor de electroni orbitali atomice sigma distinge și -bond delta pi. Sigma -bond este format ca în cazul în care norii de electroni se suprapun maxim la linia dreaptă care unește centrele atomilor (conexiune a axă). Aceasta formează o legătură în moleculă două N sub - datorită suprapunerii de nori de electroni ai atomilor doi s-electronii (cigma s - s-obligațiuni). Molecula HCI sigma -bond este format prin suprapunerea s -electron atom nori de hidrogen și un atom de clor p electroni (s -p sigma -bond) și molecule halogen diatomice - datorită suprapunerii nor de electroni atomi p-halogen (sigma p p-bond).
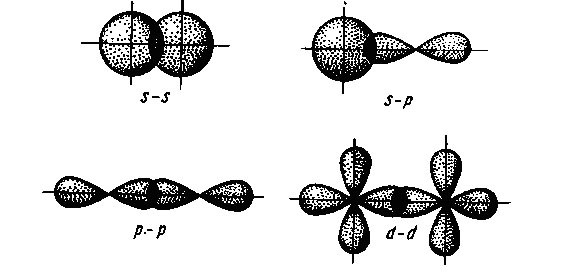
Suprapunerea orbital atomic în formarea -bonds sigma
În cazul obligațiunilor pi suprapunere maximă a norilor de electroni se realizează în două zone, dispuse simetric pe ambele părți ale legăturii. De exemplu, o moleculă de azot, împreună cu un sigma -bond, au două legături pi care rezultă din suprapunerea de nori de electroni alte p electroni (Pi rr - obligațiuni).
În cazul în care imaginea unei conexiuni simplu, este întotdeauna o sigma-obligațiuni, în cazul în care multitudinea de link-urile de mai sus, o legătură între atomii - Sigma - și altele - obligațiuni pi.
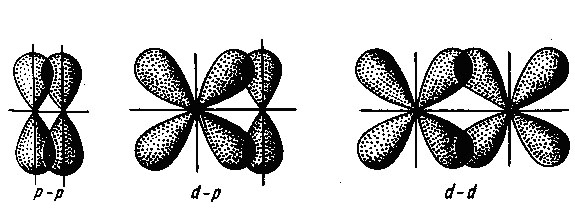
Suprapunerea orbital atomic în formarea unei legături pi
Delta-obligațiuni este format prin suprapunerea d orbitali toate cele patru petale.
Gradul de suprapunere a norilor de electroni în formarea comunicării depinde de simetria și orientarea relativă. Astfel, în cazul suprapunerii reciproce a sigma -bond s - și p nori conduc la formarea unei legături puternice, mai degrabă decât cele două suprapuse s -oblakov. Chiar legătură mai durabil apare ca urmare a suprapunerii a două orbitali p pentru a forma -bonds sigma. Acest lucru se datorează faptului că p-nori peste extins pentru a oferi o mai mare suprapunere. Cu toate acestea, în cazul suprapunerii obligațiunilor pi are loc într-o măsură mai mică, deoarece se realizează porțiunile laterale deasupra și dedesubtul liniei de comunicație, în care pi-legătura mai puțin durabile decât sigma -bond.
legătură covalentă Directivitatea determină geometria moleculelor, adică, dispunerea reciprocă a atomilor și unghiurile dintre legăturile.
Când formarea orbitalii de legătură cu diferite forme și puterea este hibridizarea lor, adică, Alinierea formei și energie. Se presupune că, în urma suprapunerii mai multor orbitali diferite formate același număr de orbitali hibride identice.
orbitali hibride au o formă diferită față de momentul inițial: acestea sunt alungite într-o singură direcție, și, prin urmare, gradul de suprapunere cu norii de electroni ai atomilor cu care este format de comunicare, de mai sus. Ca urmare a acestei suprapun un câștig în energie.
Conform numărul inițial distinge orbitali sp -, sp 2 -, sp3 hibridizare.
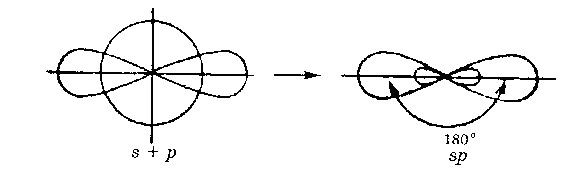
hibridizarea SP-. Un orbitală s- și p- una orbitală transformată în două orbitali identice „hibrid“, unghiul dintre axe este egală cu 180 °.
Două orbitali pot forma doi SP-s -bond (BEH 2. ZnCI2). Încă două. - conexiunea poate fi format când electronii (acetilenei C 2 H 2) sunt două orbitali P- care nu participă la hibridizare.
Molecule în care hibridizarea SP-au o geometrie liniară.
sp 2 - hibridizare. Un orbitală s- și P- orbitali două transformate în trei orbitali identice „hibrid“, unghiul dintre axe este egală cu 120 °.
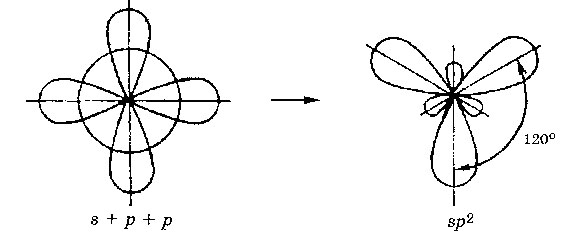
În cazul în care legătura este formată prin suprapunerea orbitalii liniei care unește nuclee de atomi, este numit e - obligațiuni. În cazul în care suprapunerea orbital în afara liniei care leagă miezul este format - conexiunea. Cele trei sp 2 - orbitali poate forma o perioadă de trei s - conexiune (BF sub 3. AICI3). O altă comunicare (- Bond) pot fi formate, dacă orbitalii P- nu sunt implicate în hibridizare, este un electron (etilen C 2 H 4).
Molecule în care sp 2 - hibridizare, au o geometrie planară.
sp 3 - hibridizare. Un orbital de orbitali și P- trei S- convertit în patru orbitali identice „hibrid“, unghiul dintre axe este egală cu 109 ° 28“.
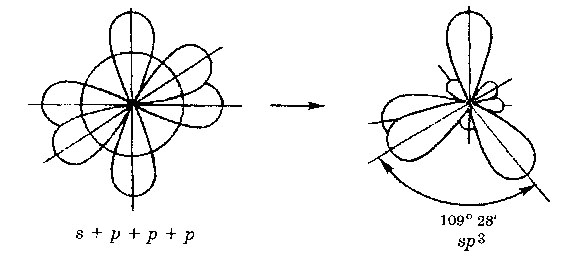
Molecule în care sp 3 - hibridizare, au o formă tetraedrică (CH 4. NH3).