Una dintre sarcinile Enzyme Engineering este de a dezvolta o tehnologie pentru producerea și utilizarea enzimelor imobilizate. enzime imobilizați sunt numite enzime asociate artificial cu purtătorul insolubil, dar își păstrează proprietățile catalitice. Această tendință a biotehnologiei a fost inițiat în anul 1916, când Dzh.Nelson și E.Griffin adsoarbe pe cărbune și invertazice a arătat că ea păstrează într-o activitate catalitică mod.
În prezent, termenul „imobilizare“ a pus un sens mai larg - restricțiile totale sau parțiale privind libera circulație a moleculelor de proteine.
enzime imobilizați au mai multe avantaje în comparație cu moleculele libere:
· Sunt catalizatori heterogeni sunt ușor separabile din mediul de reacție, ceea ce face posibilă oprirea reacției în orice moment, de a utiliza enzima în mod repetat și pentru a primi un produs curat din enzima;
· Poate fi utilizat în mod repetat și asigura continuitatea unui proces catalitic;
· Alter proprietățile sale, specificitatea de substrat, stabilitate, dependența activității de parametrii de mediu;
· Durabilă în mii și zeci de mii de ori mai stabile decât enzimele libere.
Toate cele de mai sus oferă eficiență ridicată, eficiența și competitivitatea tehnologiilor care utilizează enzime imobilizate.
Ambele enzime pot fi imobilizat prin legarea de purtători insolubili și prin reticulare intramoleculare sau intermoleculare a moleculelor de proteină cu compuși bifuncționali cu greutate moleculară mică, precum și prin atașarea la polimer solubil.
Purtătorii pentru imobilizarea enzimelor. Prin mass-media trebuie să îndeplinească următoarele cerințe:
· Chimică ridicată și stabilitate biologică;
· Durabilitate chimică ridicată;
· Permeabilitate adecvată a enzimei și substraturi, porozitatea, suprafață mare;
· Posibilitatea de obținere a unei forme convenabile tehnologic (granule, membrane);
Pentru prepararea enzime imobilizate utilizate un număr limitat de ambii purtători organici și anorganici (fig. 7.1).
Fig. 7.1. Clasificarea Purtătorii pentru enzime imobilizate
Purtătorii polimerici organici. Purtătorii polimerici organici existenți pot fi împărțite în două clase: naturale (proteine, polizaharidic și lipide) și purtători polimerici sintetici (polimetilen, poliester).
Avantajele purtători naturali. disponibilitate, multifuncționalitatea și hidrofilă; Dezavantaje: cost ridicat și biodegradabilitatea.
Pentru imobilizarea polizaharide mai frecvent utilizate celuloză, dextran, agaroză și derivați ai acestora. Pentru a da stabilitate chimică lanțuri lineare de celuloză și dextran reticulat cu epiclorhidrină. Structura reticulară obținută a prezentat diverse grupe ionice. Modificarea chimică a crosslinkers amidon (formaldehidă, glioxal, glutaraldehidă) nou purtător sintetizat - amidon burete, având o rezistență crescută la glicozidazele.
Din aminosaharidov naturale ca purtători de utilizat chitină. Chitina este stabil chimic și are structura porilor bine definita.
Dintre proteinele utilizate ca purtători de proteine structurale - keratină, fibroină, colagen și gelatină (colagen de prelucrare a produsului). Proteine capabile de biodegradare, care este foarte importantă în proiectarea enzimelor imobilizați de uz medical. Dezavantajele ambelor purtători de proteine, în acest caz, ar trebui să includă imunogenitatea lor ridicată.
Purtătorii polimerici sintetici. Majoritatea transportatorilor polimerice sintetice au o rezistență mecanică, precum și posibilitatea de variație în limite largi de pori de dimensiuni. Unii polimeri sintetici pot fi produse în diverse forme fizice (conducte, fibre, granule). Acestea includ polimerii pe bază de stiren, acid acrilic, alcool polivinilic; poliamidă și poliuretan polimeri.
Purtători de natură anorganică. Ca suporturi materiale din sticlă utilizate în mod obișnuit, argile, ceramica, grafit negru de fum, silice și oxizi metalici silochrome. Acestea pot fi supuse modificărilor chimice, care sunt purtătorii acoperite cu o peliculă de oxid de aluminiu, titan, zirconiu sau tratat cu polimeri organici. Principalul avantaj al transportatorilor anorganici - ușurința de regenerare. Asemenea polimeri sintetici purtători anorganici pot fi date sub orice formă și le primesc cu orice grad de porozitate.
Metodele de imobilizare a enzimelor
Există două metode fundamental diferite de imobilizare enzimatică: (. Figura 7.2) fizice (fără apariția de legături covalente între enzimă și purtător) și chimic (formând o legătură covalentă între ele).
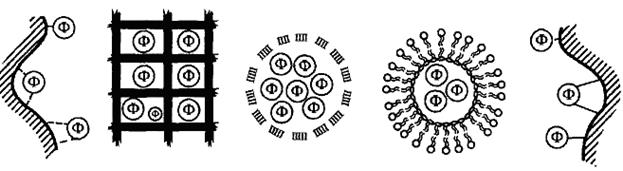
Figura 7.2. Metode pentru metode de imobilizare enzimatică de imobilizare fizică: a - adsorbție; b - includerea în gel; în - încapsulare; g - includerea în lipozomi; Metode de imobilizare chimice: e - legare covalentă
Metodele fizice immobilazatsii reprezintă includerea enzimei într-un mediu în care să-l este disponibil doar o parte limitată din volumul total. In imobilizarea fizică a enzimei nu este legat la un purtător prin legături covalente. Există patru tipuri de enzime de legare.
Adsorbția de enzime pentru purtători insolubili. Adsorbția a fost prima metodă de enzime imobilizeze a devenit cea mai utilizată metodă de producere a enzimelor imobilizate în industrie. Silicea utilizată ca adsorbanți, cărbune activ, grafit negru de fum, diferite argile, sticlă poroasă, polizaharide, polimeri sintetici, oxizi de aluminiu, titan și alte metale. Când imobilizarea adsorbtivă a moleculei de proteină este reținută pe suprafața purtătoare datorită,, interacțiuni hidrofobe dispersie electrostatice și legături de hidrogen. eficiența adsorbției este determinată de o suprafață specifică (densitatea siturilor sorbție) și un purtător poros.
Adsorbția de enzime pentru purtători insolubili este simplu și se realizează prin contactul unei soluții apoase de enzimă, cu un purtător (metoda statistică, cu agitare, un mod dinamic folosind coloane). În acest scop, soluția de enzimă este amestecată cu nămolul proaspăt, de exemplu, hidroxid de titan, și se usucă în condiții blânde. Activitatea enzimatică în această imobilizare variantă reținută aproape 100%, iar concentrația de proteine specifice este de 64 mg per 1 g de purtător.
Dezavantajele metodei de adsorbție includ rezistență scăzută legarea enzimei la un suport (schimbarea condițiilor de desorbție se poate produce imobilizarea enzimei, pierderea și contaminarea produselor de reacție sale). Puterea de legare a enzimei transportatorului poate îmbunătăți modificarea preliminară a presei (procesarea ionilor metalici agenți polifuncționale - polimeri, proteine, compuși hidrofobi, un monostrat de lipide, etc.). Uneori, molecula modificări suferă enzima părinte, dar de multe ori duce la o scădere a activității sale.
Imobilizarea enzimelor prin includerea în gel. Metoda de imobilizare a enzimelor prin includerea în structura tridimensională a gelului de polimer este foarte răspândită datorită simplității și unicitatea. Metoda este aplicabilă nu numai pentru a imobiliza enzimelor individuale, ci chiar și complexele multienzimnyh și celulele intacte. Imobilizarea enzimelor în gelul se realizează în două moduri:
· Enzima este introdus în soluția apoasă de monomer este apoi polimerizat, care apare ca urmare a structurii spațiale a gelului de polimer cu inclus în moleculele de enzime celulare; folosind geluri de poliacrilamidă, alcool polivinilic, polivinilpirolidonă, gel de silice;
· Enzyme introduse în polimer terminat deja soluția, care este transformată ulterior în starea de gel; folosind geluri de amidon, agar-agar, caragenan, agaroză, fosfat de calciu.
Avantajele imobilizarea enzimelor in geluri includ:
· Repartizarea uniformă a enzimei într-un volum de mediu;
· Înaltă mecanică, chimică, stabilitate termică și biologică a matricei;
· Enzimă Reutilizabilitate, inclusă în structura sa.
Cu toate acestea, metoda nu este adecvată pentru imobilizarea enzimelor care acționează pe un substrat insolubil în apă.
Imobilizarea enzimelor în structura semipermeabilă. Esența acestei metode de imobilizare - separarea soluției apoase din soluția apoasă substrat enzimatic prin membrana semipermeabila molecula permeabilă substraturilor cu greutate moleculară mică și cofactori, dar intarzierea molecule de enzime mari.
Cele mai des utilizate două versiuni ale acestei metode - microencapsulation și includerea enzimelor în lipozomi.
Microîncapsularea este că soluția apoasă de enzimă este inclusă în microcapsule închise ale căror pereți sunt formate dintr-un polimer semi-permeabil.
Mărimea capsulelor se obține prin zeci sau sute de micrometri, iar grosimea membranei - câteva sutimi de micrometri.
Avantajele metodei de microcapsulare:
· Reutilizarea enzimei native (enzima poate fi separat de substrat nereacționate și produșii de reacție de procedură simplă filtrare);
· Posibilitatea de a imobiliza enzimele nu numai individul, dar are, de asemenea, complexe, mai multe celule întregi și fragmente de celule.
Dezavantajele metodei includ incapacitatea de a enzimelor încapsulate pentru a efectua conversia substraturilor macromoleculare.
Includerea soluțiilor apoase de enzime în lipozomi. Pentru lipozomi de soluții lipidice (de obicei lecitină), se evaporă solventul organic. Rezidual Filmul lipidic subțire dispersat într-o soluție apoasă care conține enzima. În procesul de auto-asamblare se produce dispersa structurile lipidice bistratificate lipozomi care conțin soluție de enzimă încorporată.
Enzimele sunt imobilizate prin includerea în structura lipozom, utilizate în scopuri medicale și științifice în primul rând. Studiul a lipozomilor este de mare importanță pentru înțelegerea modelelor de procese celulare de viata, la fel de mult de enzimele din celula localizate în compoziția matricei lipidice a membranelor biologice.
Metodele chimice de imobilizare enzimatică. Imobilizarea enzimelor prin formarea unei noi legături covalente între enzimă și purtătorul - modul cel mai masiv de iradiere a biocatalizatori industriale.
Spre deosebire de metodele fizice, această metodă asigură o imobilizare puternică și legătură ireversibilă cu purtătorul enzimatic, și este adesea însoțită de stabilizarea moleculei enzimei. Cu toate acestea, aranjamentul enzimei în raport cu purtătorul la o distanță de o legătură covalentă creează dificultăți în implementarea procesului catalitic. Enzima este separată de purtătorul prin inserarea (reticulare, de distanțare) care acționează ca adesea agenți bifuncționali și polifuncționale (bromură de cianogen, hidrazină, clorură de sulfuril, dialdehidă glutarică, și altele.).
Este esențial ca enzima implicată în grupele funcționale de imobilizare nu sunt esențiale pentru funcția catalitică. Astfel, de obicei atașat la glicoproteinele prin carbohidrat ca purtător, nu prin partea proteică a moleculei de enzimă.
Toate metodele de imobilizare chimice sunt clasificate în funcție de natura grupei mediu de reacție, reacționează cu molecula de enzimă.
Imobilizarea enzimei pe suporturi cu gidroksogrupp. Cea mai comună metodă de formare a unei legături covalente între enzimă și purtătorul sau compus polizaharidic diol sintetic este metoda bromtcianovye. In tratamentul suportului cu bromură de cianogen având cianurile imidokarbonaty reactive și care, în interacțiune cu grupările amină nucleofile ale enzimei și formează un derivatele izouree uretani:
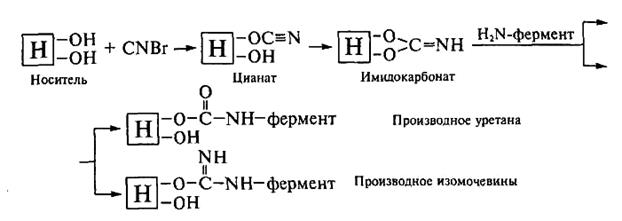
Imobilizarea enzimelor pe purtătorul având grupări amino. Primar purtător grupări amino asociate cu un inel aromatic, convertit anterior sarea de diazoniu, care este apoi supus la o varietate de reacții de cuplare. În reacția de cuplare veni fenolice, imidazol, amină, guanidină, grupe tiolnte de proteine.
Imobilizarea pe suporturi care au activat derivați ai grupării carboxil. Cel mai adesea pentru compușii cu grupări acil amino ale grupărilor purtătoare de proteine utilizate anhidride acide, halogenuri acide, esteri activi și alți derivați de acid carboxilic.
Imobilizarea pe suporturi care posedă grupări sulfhidril. grupări sulfhidril de purtător și enzima sunt ușor oxidat pentru a forma legături disulfidice sub influența oxigenului aerului:
Avantajele imobilizare chimice - de înaltă performanță și o rezistență a legăturii. Cu toate acestea, metodele de imobilizare covalentă nu sunt disponibile pentru utilizare industrială, din cauza complexității și scumpete de aplicare a acestora.