Căldura este întotdeauna transferată de la un corp mai cald la o mai cald, cu alte cuvinte, dintr-un corp de înaltă temperatură - corpul la o temperatură scăzută.
Să presupunem că cele două substanțe sunt amestecate fără formarea unei reacții chimice, adică. E. Nu există nici o eliberare sau absorbție de căldură. În acest caz, putem spune că transferurile de căldură egală cu căldura primită. În acest caz, presupunem că apare mediul de transmitere a căldurii.
Căldura care se transferă o singură substanță la alta în timpul amestecării, căldura este primită de către o altă substanță.
Cu alte cuvinte, transferul de căldură va avea loc atât timp cât temperatura materialului nu este egal.
Această definiție este utilizată în practică, atunci când transportă amestecul de gaz lichefiat de propan și butan, cu capacități diferite și temperaturi diferite, atunci când amestecate la bord.
În acest caz, putem calcula în avans temperatura unui amestec de gaze lichefiate, cunoscând parametrii inițiali ai fiecărui gaz, înainte de amestecarea lor. Și cunoscând temperatura amestecului, putem determina presiunea din rezervor, iar densitatea încărcăturii.
În primul rând, vom scrie sub forma unei formule deja cunoscută egalitate - egală cu căldura primită de căldura dată departe:
unde jumătatea stângă a ecuației determină căldura unui lichid, iar dreapta - căldura celuilalt. Cele mai multe pur și simplu, acest lucru poate fi considerat ca un exemplu.
EXEMPLU: Se combină 5 kg de propan la o tp = temperatura de -40 ° C și 8 kg de butan, la o tb temperatură = 2 ° C Capacitatea termică specifică a propanului cp = 2,476 J / kg K, și cb butan = 2,366 J / kg K. Definim temperatura amestecului Gaze tm.
Soluție: Este clar că Tb> Tm> Tp, și pot fi scrise pentru propan
În cazul nostru,
ΔTp = (Tm - 233); ΔTb = (275 - Tm). Se calculează temperatura amestecului în conformitate cu formula (1):
• mp = cp ΔTp cb = mb • • ΔTb = 5 • 2476 • (Tm -233) = 8 • 2366 • (275 - Tm) • Tm = 12,380-2,884,540 =
= 5205200 - 18928 • 31308 • Se Tm Tm = 8089740, sau
Tm = 258.39 = 8089740 = 258.4-273 = -14,6 ° C
În cazul general, calculul temperaturii amestecului poate fi exprimată prin formula:
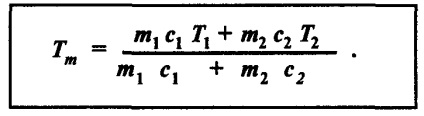
legea lui Dalton poate fi exprimată după cum urmează:
în care pT - presiunea totală a amestecului de gaz; pA + pB - presiunea parțială a fiecărui gaz; nA - numărul de moli de gaz A în ecran; nVersiunea - Numărul de moli de gaz în volum; gaz universal R- constantă egală cu 8.314 J / (mol • K); T - temperatura absolută a amestecului de gaz; amestec volum de gaze m3 V.
Presiunea amestecului de gaz este suma presiunilor parțiale ale fiecăruia dintre gazele care formează amestecul.
Presiunea parțială - o presiune a gazului curat (fără aditivi), într-un volum dat, la o temperatură predeterminată.
Pentru a calcula conceptul de concentrare în masă a presiunii gazului amestec se utilizează g i și concentrația molară ri gaz,
în care masa gazului GiiGcm- și masa amestecului de gaz; cantitate niincm- de gaz substanță și un amestec de gaz (mol).
La transportarea unui amestec de gaze lichefiate este important să se știe cât de mult presiunea va fi în rezervor, la o temperatură dată. Acest lucru este necesar pentru determinarea parametrilor unei instalații de compresare.
Luați în considerare câteva metode simple de calcul a presiunii de vapori, în cazul în care compoziția molară cunoscută a amestecului sau greutatea încărcată la bord.
Exemplu: Nava trebuie scufundați amestec gazos, format din 100 tone și 400 tone propan Temperatura amestecului butan este -8 ° C (a se vedea calculul temperaturii amestecului de gaz.). Saturați presiunea vaporilor de propan la această temperatură pentru un anumit grafice sau extrase din tabelele de 3,69 bar. O presiune de vapori de butan la aceeași temperatură de 0,78 bari. Este necesar să se determine presiunea amestecului de vapori saturați (vol. E. Presiunea totală din rezervor) și compoziția procentuală a fazei gazoase de deasupra suprafeței lichidului.
Soluție: Se calculează raportul molar dintre propan și butan în amestec. În acest scop, definim molar propan-butan ing masă și C3H8 C4H10. Cu tabelul periodic al elementelor, descoperim că un atom de carbon are o masa de 12.01115 g / mol, iar atomul de hidrogen - 1.00797 g / mol.
Apoi, masa molară propan 12.01115 g / mol x 3 = 36.03345 g / mol
1.00797 g / mol x 8 = 8.06376 g / mol s
44.09721 g / mol = 44,1 g / mol;
molar butan masa 12.01115 g / mol x 4 = 48.0446 g / mol