Acid sulfuric. Raw. Prepararea dioxidului de sulf
Acid sulfuric - unul dintre produsele de bază chimice lot tonaj. Este folosit în diverse sectoare ale economiei, deoarece are un set de funcții care facilitează utilizarea tehnologiei sale. Acidul sulfuric nu este fum, nu are nici o culoare, miros, la temperatura obișnuită este într-o stare lichidă. In forma concentrata nu se corodează metale feroase. În același acid sulfuric timp este unul dintre acizii minerali tari, numeroase forme de săruri stabile și este ieftin. Anhidru H2SO4 acid sulfuric (monohidrat) este un lichid greu, uleios, care este miscibil cu apa în orice proporție cu eliberarea unei cantități mari de căldură.
Materii prime de proces: pirită, sulf elementar, serovodo tija, sulfuri metalice, cum ar fi calcopirita CuFeS2, CuS2 chalcocite, sulfați de gips CaSO42H2O, anhidrit CaSO4, mirabilită Na2SO410H2O etc.
Prepararea sulf urlând gaz din hidrogen sulfurat recuperate în tehnica de purificare si combustibil gaz-ically, pe baza procesului de oxidare parțială pentru torusului solid-catalizei. În acest caz apar reacții:
Cantități semnificative de sulf pot fi preparați din prin pro-duk-ing metale neferoase, cum ar fi cupru:
Arderea sulfului se consumă 1 mol 1 mol pis loroda. Aceasta produce 1 mol de dioxid de sulf:
S (gaz) + O2 (gaz) = S02 (gaz) -j - 362,4 kJ (86,5 kcal).
Hidrogen sulfurat este arsă pentru a forma și de H20 S02:
2H2S + 302 = 2S02 + 2H20-f 1038,7 kJ (247,9 Kcal).
Formată în vaporii de apă provenind din amestecul de gaze în aparatul de contact urlând, și din ea să absoarbă valorile-TION.
producția clearance-ul tehnologic al acidului sulfuric din pirita este mai complexă și constă din mai multe etape realizate secvențial.
Diagrama schematică a producției prezentată în Fig.
1 - obținerea de gaz calcinat: 1 - pirita de prăjire, 2 - răcirea gazului într-un cazan recuperator, 3 - curățarea totală a gazelor, 4 - gaz de curățare special; 11 - contactarea: 5 - încălzirea cu gaz într-un schimbător de căldură, 6 - contactarea; 111 - absorbție: 7 - absorbția oxidului de sulf (6) și formarea acidului sulfuric.
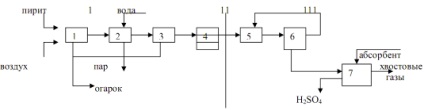
Dioxid de sulf S02 - este un gaz incolor, de 2,3 ori mai grele decât aerul, cu miros înțepător. Când dizolvat în apă format un SO2 acid sulfuros slab și instabil + H2O = H2SO3.
2.Ugol. Prepararea de cocs.
cărbuni cocsificabil
O parte semnificativă a cărbunelui a fost supus la temperaturi ridicate (pirogeni-ti-cal) prelucrare chimică. Scopul acestei prelucrări - producția de produse secundare valoroase utilizate în continuare drept combustibil și produse pro-intermediar pentru sinteza organică. Scop și condiții ale procesului de prelucrare a cărbunelui pirogenetic este împărțit în trei tipuri: Pyro-lys, gazeificare, hidrogenare.
Piroliza sau cracare - un proces de încălzire a combustibilului solid fără accesul aerului pentru a produce gazoase, lichide și produse solide pentru diverse scopuri. Sunt piroliza la temperaturi ridicate (carbonizare) și piroliză la temperatură scăzută (carbonizare).
Carbonizare se realizează la 500-580 ° C pentru a obține guvernamentale chin-lichizi și gazoși. Produsele carbonizare sunt Rieux-sy pentru sinteza organică, rășina (sursa producătoare de carburanți), monomeri sol-ri-TeLi și char pentru a fi utilizat ca aditiv pentru combustibili local și taxa pentru cocsare.
procesele de hidrogenare și gazificare sunt utilizate pentru producerea de produse lichide din cărbune utilizat drept carburant și gaze combustibile.
cărbune cocsificabil se realizează la o temperatură de 900 - 1200 C pentru a produce cocs și gaze combustibile și materii prime pentru industria chimica.
Companiile, care se realizează cărbune cocsificabil, numit cocs. Există cocseriile separate cu o producție de cocs ciclu jumătate de NYM să fie amplasate separat de întreprinderi me-tallurgicheskih și subprodus cocserie în compoziția plantelor metal RGI-cal.
Schema bloc a producției de cocs prezentat în Fig.
depozit PKG Cox
Răcire și separare