chimie nucleofil (latină nucleu «nucleu», greaca veche φιλέω «dragoste» ..) - reactiv care formează o legătură chimică cu un partener prin reacția (electrofil) a mecanismului donor-acceptor, oferind o pereche de electroni care formează o nouă relație [1] . Deoarece nucleophiles dona electroni, ele sunt prin definiție baze Lewis. În rolul nucleofili ar putea servi, teoretic, toți ionii și moleculele neutre, cu o pereche de electroni unshared.
reactiv chimic ELECTRON capabil să reacționeze cu electroni compușilor (electrofile) - nucleofil. Exemple de nucleofile sunt anioni (Cl -. Br. - I -) și un compus cu o pereche de electroni unshared (NH3 H2O).
În timpul reacțiilor de adiție sau substituție atac nucleofil la locul de o sarcină pozitivă totală sau parțială de pe electrofilul. Numele de „nucleofil“ înseamnă „miez iubitoare“ și afișează această abilitate (nucleul atomic încărcat pozitiv). Reactivitatea relativă a nucleofili numit nucleofilicitate. Intr-un singur rând al sistemului periodic al bazelor puternice (cu o valoare mai mare pKa al acidului conjugat) sunt nucleofili mai bune. In cadrul unui grup să influențeze nucleofilicitatea mai mare polarizabilitatea - ușurința cu care deformează norul de electroni al unui atom sau moleculă. De exemplu, ionul iodură în soluții apoase de I - mai mult decât nucleofila fluorură, F - [2].
nucleofili Ambident au două sau mai multe site-uri reactive. De exemplu, SCN ion tiocianat - poate ataca electrofil sau un atom de sulf sau un atom de azot. reacția galogenoalkanov cu SCN - conduc adesea la formarea unui amestec RSCN (alkiltiotsianata) și RNC -uri (alkilizotiotsianata).
Termenii „nucleofili“ si „electrofil“ au fost introduse în 1929 de către Christopher Ingold [3]. înlocuirea propusă anterior (în 1925) Lepvorsom "kationoid" și "anionoid" [4].
În exemplul următor bimolecuă substituție nucleofilă (SN 2) hidroxid de un atom de oxigen ion donează o pereche de electroni de legare la un atom de carbon în molecula brometan. Comunicarea dintre carbon și brom este rupt prin mecanism heterolitice: bromo primește ambii electroni și lasă acest context ca un ion Br -. În această reacție, OH - este nucleofil și CH3 CH2 Br - electrofil.
In această reacție, atacul nucleofil are loc pe partea opusă grupa care pleacă. În consecință, SN-2 procese sunt însoțite de conversie (inversiune) de configurare.
clasificare
Nucleofili pot fi clasificate în mai multe moduri: prin orbitalii de tip, care doneaza electroni. și prin natura atomului care formează legătura.
În funcție de tipul de orbitali reactive
În funcție de natura orbitali pe care electronii poshedshie în formarea legăturii cu un electrofil. pot fi identificate:
Prin atom, formează o legătură
nucleofili de carbon
Nucleofile la centrul de reacție la atomul de carbon sunt:
- și alchil arilmetallogalidy (de exemplu, CH3MgBr, PhMgCI și t. d.) în reacțiile Grignard. Reformată. Barbier și colab.
- organolitiu (PhLi) și anioni de alchine terminale (HC = - Li +);
- enoli și enolații (RCH = CH-OH și RCH = CH-O -) sunt nucleofile ambident și pot reacționa atât la atomul de carbon din poziția α-și atomul de oxigen. În mod tipic, reacția este dominată de un atom de carbon (ionilor enolat enolii activi [2]). Enol și enolații adesea utilizate în reacțiile de condensare cum ar fi reacția aldolică sau condensare Claisen.
- alte particule cu sarcină totală sau parțială negativă asupra atomului de carbon (de exemplu, - CH2 -NO2).
nucleofile de azot
nucleofile oxigen
nucleofile de oxigen tipice includ apa (O H2), ioni de hidroxid (OH -), alcooli (ROH) și alcoxizii (RO -). Așa cum se arată mai jos specii de alcool reacție Williamson este deprotonat bază puternică pentru a forma alcoxid. atom de oxigen înlocuiește apoi intramoleculară grupă labilă, având ca rezultat formarea unui epoxid - heterociclu trinomial cu un atom de oxigen:
nucleofili de sulf
compuși care conțin sulf în mod tipic sunt nucleofili bune, deoarece atomul de sulf este polarizat cu ușurință, ceea ce facilitează transferul unei perechi de electroni. nucleofile tipice ale acestei clase - tiolilor (RSH) și tiolați (RS -).

scară nucleofilicitate
Mai multe metode pentru descrierea cantitativă a reactivității nucleofili. Următoarele metode se bazează pe studiul datelor experimentale asupra ratei anumitor reacții care implică un număr mare de nucleofili și electrofili. În mod tipic, reactivii cu alfa efect pronunțat nu sunt incluse în aceste corelații.
ecuația Sven-Scott
Ecuație Sven-Scott a fost retras în 1953 și este prima încercare de a descrie cantitativ reactivitatea nucleofili în SN 2 Reacții [5] [6]:
În această ecuație, k - constanta vitezei de reacție standard de substrat cu nucleofil, k0 - constanta vitezei de reacție a substratului cu nucleofil etalon (apă), S - parametru substrat sensibilitate la o modificare nucleofil (pentru CH3 Br sau CH3 este luată egală cu 1), n - parametru nucleofilicitate (apa n = 0, tab. 1 și 2).
Astfel, pentru reacțiile
ecuația Sven-Scott poate fi scris ca
Tabel. 1. Parametrii pentru n nucleofilicitate standard a nucleofil standardul CH3 Br solvent și H2O la 25 ° C [7]
O caracteristică importantă este absența Ritchie substrat ecuația parametru de sensibilitate (σ în ecuația Sven-Scott). Astfel, se presupune că reactivitatea relativă a celor două nucleofili determinată numai de valoarea N + și este independentă de partenerul de reacție. Acest lucru este în contrast puternic cu m. N. Principiul interdependenței reactivității și selectivitate. [11] Din cauza acestei ecuații Ritchie uneori denumit „constanta raport de selectivitate“ [12]. Simplitatea absolută a cauzat o serie de publicații cu privire la limitele aplicabilității acesteia [12] [13].
În această ecuație, a doua viteză de ordinul k constant al reacției. măsurată la 20 ° C, asociat cu parametrul electrofilie E (pentru bis (p-metoxifenil) metil cation E = 0), parametrul N și factorul de sensibilitate nucleofilicitate s (pentru reacția 2-metil-1-pentena s = 1). Pentru reacțiile de constanta vitezei de nucleofili neîncărcată depinde slab de solvent și acesta din urmă nu este indicată de obicei.
cationi Diarilmetilnye au fost selectate ca electrofili standard, deoarece activitatea lor poate controla selecția de substituentul R în poziția para-. Astfel, a fost posibil să se măsoare foarte diferite de reactivitate a nucleofili. Pentru compușii testați, parametrul N este schimbat în intervalul de la -4,47 la 28,95 (Tab. 4) [15].
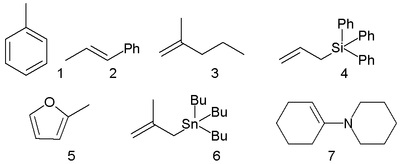
Unele nucleofili, pentru care parametrii măsurați nucleofilicitatea N
Tabel. 4. Parametrii N și S pentru anumiți agenți nucleofili [15]
Parametrul E elekrofilnosti unele carbocationilor poate fi estimată aproximativ prin următoarea ecuație [14]:
,
unde kw - constantă pentru pseudo reacție prim ordin al carbocationului cu apă la 20 ° C
Ecuația combinată
,
Cu substituțiile adecvate ca expresia pot fi transformate în orice descris anterior de ecuația:
notițe
Vezi ce „nucleofil“ în alte dicționare:
nucleofil - nukleofilas statusas chemija T sritis apibrėžtis Dalelė, turinti laisvą elektronų pora ar didesnį elektronų Tanki. atitikmenys: angl. Rus nucleofili. nucleofil ... Chemijos terminų aiškinamasis žodynas
Reacțiile de substituție nucleofilică - (. Engl reacție de substituție nucleofilă) reacție de substituție în care atacul nucleofil transportă reactiv purtând o pereche de electroni unshared [1]. Gruparea scindabilă în reacțiile de substituție nucleofilă numit nucleofug. Toate ... Wikipedia
TELE-substituit - substituția (tipic nucleofil.) In apo Matic. sau geteroaromatich. rând la un grup de intrare rom vine într-o poziție situată printr-unul sau mai mulți atomi ai grupului fugace; desemnat ... Encyclopedia chimică
NITROSOEDINENIYA - (C nitro) conțin per moleculă una sau mai multe. grupe nitro legat direct la un atom de carbon. De asemenea, cunoscut N și compusul O nitro (vezi. Nitrații Nitramines și organice). gruparea nitro are o structură intermediară între cele două ... ... enciclopediei chimice
reacție nucleofilă - geterolitich. p TION org. Conn. cu un nucleofil. agenți (nucleofili, din lat. miezul nucleului si greaca. dragoste phileo). K și y k l e de f și n și m includ molecule și anioni (Org. Și săruri anorganice.), Secara la participarea la p țional dat perechea sa de electroni la formarea ... Chemical Encyclopedia
reacție de adiție - (. Engl reacție de adiție) în chimia organică așa-numitele reacții chimice, în care un compus chimic atașat unui multiplu relații (duble sau triple), alți compuși chimici. Conexiunile pot ... ... Wikipedia
Benzopyrylium SARE - (hromiliya sare) conținută într-o structură benzopyrylium cation moleculă I sau II. Chem. legarea wa aceste structuri sunt diferite datorită naturii oxigenului fenolic al cetonei în zonele I și II Cps. Nu face schimb atomul de oxigen de la al. Și hetero atomi nu sunt convertiți. ... ... Chemical Encyclopedia
Wagner Meerwein rearanjamente - nume comun. p țiilor care apar din grupul 1.2 migrație R (H, alchil sau fragment alitsiklich., arii, acil, alcoxicarbonil, etc.) la centrul carbocationului care apare în moleculă cu un nucleofil. substituție, adiție la legătura multiplă sau eliminarea ... encyclopedia chimice
- Ingold, Christopher Kelco. Dzhessi Rassel. Această carte va fi făcută în conformitate cu comanda pe tehnologia de imprimare Tehnologie-on-Demand. Conținutul de calitate înaltă prin articole wikipedia! Cree? Stofer Kelco Și? Ngold (Ing. Christopher Kelk ... Citește mai mult Cumpără pentru 1.125 de ruble