Ținta C2 EGE chimia este o descriere a experimentului chimic, prin necesitatea de a face reacția ecuația 4. Conform statisticilor, aceasta este una dintre cele mai dificile sarcini, un procent foarte mic predarea face față cu ea. Următoarele sunt recomandări pentru decizia C2 sarcinii.
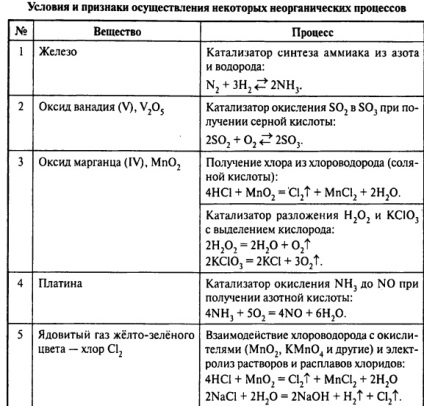
În - În primul rând, dreptul de a decide examenul de sarcină C2 în chimie trebuie să identifice în mod corect acțiunile care sunt expuse la substanța (filtrare, evaporare, ardere, calcinare, sinterizare, fuziune). Trebuie înțeles, în cazul în care o substanță este un fenomen fizic, și unde - o reacție chimică. Cele mai frecvent utilizate substanțe cu etapele descrise mai jos.
Filtrarea - metoda de separare a amestecurilor eterogene folosind filtre - materiale poroase, lichide transmisive sau gaz, dar solidele întârziere. În separarea amestecurilor care conțin o fază lichidă pe filtru este solid, filtratul trece prin filtru.
Evaporarea - procesul de concentrare soluții prin evaporarea solventului. Uneori evaporarea se efectuează până la o soluție saturată, pentru cristalizarea ulterioară a acestor solide în formă cristalină, sau până la evaporarea completă a solventului pentru a se obține substanța dizolvată în formă pură.
Calcinarea - încălzirea substanței pentru schimbarea compoziției sale chimice. Calcinarea poate fi efectuată în aer și în atmosferă de gaz inert. Calcinarea în hidrații cristalini aerul pierde apa lor de cristalizare, de exemplu, CuSO4 ∙ 5H2 O → CuSO4 + 5H2 O
Substanțe instabile termic se descompun:
Cu (OH) 2 → CuO + H2O; CaCO3 → CaO + CO2
Sinterizarea, contopirea - încălzire doi sau mai mulți reactanți solizi, conducând la interacțiunea lor. Dacă reactivii sunt rezistente la agenți de oxidare, sinterizarea poate fi efectuată în aer:
2O 3 + Na2 CO3 → 2NaAlO2 + CO2
Dacă unul dintre reactanți sau produsul de reacție poate fi componentele oxidabile aer, procedeul se realizează în atmosferă inertă, cum ar fi Cu + CuO → Cu2 O
Substanțe componente labili aer sunt oxidate în timpul calcinării, reacționează cu componente de aer:
2Su + O2 → 2CuO;
4Fe (OH) 2 + O2 → 2Fe2 O3 + 4H2O
Calcinarea - proces de tratament termic, ceea ce duce la substanțe de ardere.
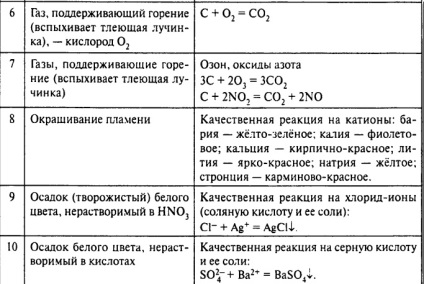
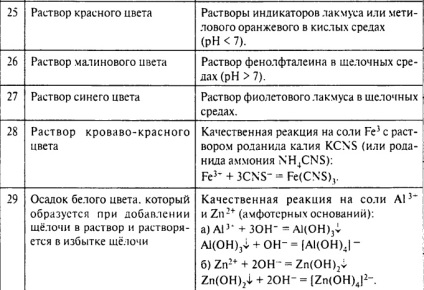
În al doilea rând, cunoașterea trăsăturile caracteristice ale materialelor (culoare, miros, stare de agregare) va servi un indiciu sau de validare activități desfășurate. Mai jos sunt cele mai caracteristice ale gazelor, soluții solide.
Semne de gaze:
Incolor, H2 inodor. N2. O2. CO2. CO (otravă), NO (otravă), gaze inerte. Toate sunt slab solubili în apă.
miros Incolor: HF, HCl, HBr, HI, SO2 (mirosuri ascuțite), NH3 (amoniac) -bun solubil în apă și otrăvitoare, PH3 (usturoi), H2 S (ouă stricate) - puțin solubil în apă, sunt otrăvitoare.
Soluții colorate:
Galben: Cromat de, de exemplu K2 CrO4. soluții de săruri de fier (III), de exemplu, FeCl3.
Orange: apă de brom, cpirtovye și soluții alcoolice apoase de iod (în funcție de concentrația de galben până la brun). bicromați, de exemplu, K2 Cr2 O7
Verde: Hydroxocomplexes crom (III), de exemplu, K3 [Cr (OH) 6], sare de nichel (II), de exemplu NiSO4. manganații, de exemplu, K2 MnO4
Albastru: săruri de cupru (II), de exemplu SuSO4
De la roz la violet: permanganat, de exemplu, de KMnO4
De la verde la albastru: săruri de crom (III), de exemplu, CrCl3
precipitații vopsite:
Negru, negru si maro: Sulfurile de cupru, argint, fier, plumb,
Green: Cr (OH) 3 - albastru-verde, Fe (OH) 2 - verde murdar, maro rândul său, în aer
Alte substanțe colorate:
sulf galben, aur, cromatul
Orange: cupru oksid (I) - Cu2 O, bicromați
Gri luciu metalic: grafit, siliciu cristalin, iod cristalin (sublimare de la - vapori violet), cele mai multe metale.
În al treilea rând, atunci când sarcinile de decizie C2 chimiei în scopuri de claritate, pot fi recomandate pentru a fi schema sau secvența de transformări substanțe derivate.
În cele din urmă, în scopul de a rezolva astfel de probleme, este necesar să se cunoască cu precizie proprietățile metalelor, nemetalelor și compușii acestora: oxizi, hidroxizi, săruri. Este necesar să se repete proprietățile azotic și acid sulfuric, permanganat și dicromat de potasiu, proprietățile redox ale diferiților compuși, electroliza topiturilor și soluții de diferite substanțe, reacția de descompunere a compușilor din diferite clase de hidroliză a sărurilor amfoter.