În acest termen, există alte utilizări, a se vedea. Cap (dezambiguizare).
Cap (5'-cap, capacul-structura) (de la cap English -. Cap) - una sau mai multe nucleotide modificate la capătul 5 'al transcriptului. sintetizat prin ARN polimeraza II. Din punct de vedere chimic, capacul este un 7-methylguanosine, lipire conductor 5“, punte 5'-trifosfat la reziduu al primei nucleotide a transcriptului. Într-un sens restrâns, se înțelege acoperit cu 7 methylguanosine. În plus, primele două nucleotide ale transcriptului poate fi metilat de 2'-O-poziția de riboză. Cap promovează eficient procesată pre-ARNm ARNm exportul din nucleu, traducerea și protecția împotriva degradării rapide [1] [2].
Tipuri de plafonare structura și prevalența acestora
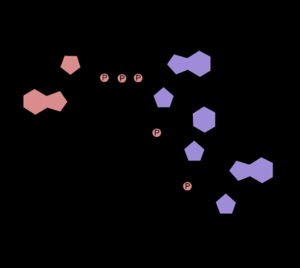
Structura capătului 5 'al ARNm plafonat
Marea majoritate a eucariot capătul 5 'al transcriptelor sintetizate prin ARN polimeraza II. co-transcripțional modificată prin adăugarea de 7-methylguanosine sau capac (vezi. figura). ARN polimeraza II sintetizeaza toate pre-mRNA, unele ARN nuclear mic și RNAs mici nucleolari. Viruși. care sunt adaptate să trăiesc în celulele eucariote pot fi, de asemenea, limitat ARN, indiferent dacă acestea sunt sintetizate prin ARN polimeraza II sau o altă enzimă [3]. În funcție de tipul de organism și tipul structurii inițiale capac ARN poate fi supus unor modificări suplimentare, în principal, de metilare [4].
Următoarele tipuri de capac:
- Cap 0 (m 7 GpppNp, în care N - orice nucleotidă) - este structura minimă de acoperire care reprezintă 7-methylguanosine, lipire conductor 5“, pod 5'-trifosfat la prima nucleotidă a ARN-ului [2]. Cap 0 recunoscut de factorul de inițiere a translației eIF4E [5];
- Cap 1 (m 7 GpppNm2'-O p) diferă de 0 capacul metilare prima nucleotidă a transcriptului poziției 2'-O din riboză;
- Cap 2 (m 7 GpppNm2'-O pNm2'-O p) este diferit de 0 capac metilare prima și a doua transcriptul de nucleotide a poziției 2'-O din riboză;
- 4 Capac (m 7 GpppNm2'-O pNm2'-O-O pNm2' pNm2'-O p);
- Capac 2,2,7-trimetilguanozinovy (m 2,2,7 GpppNp)
Cap 0 ARN caracteristic plantelor (și virusurilor de plante) și fungi. la animale este rară. Pentru animalele de ARN caracterizat capac 1 și capacul 2, raportul dintre care într-o celulă depinde de tipul de organism. virusuri animale, de asemenea, tendința de a utiliza un capac sau capac 2. Interesant, virusurile ARN de animale după prima nucleotidă a 7-methylguanosine este de obicei purinic. care poate fi opțional metilată bază azotată de atomi (de exemplu, pentru a forma N 6 -metiladenozina). În același capac ARNm celular după prima nucleotidă poate fi oricare dintre cele patru, și este, de asemenea, de obicei, în continuare metilat. In general, putem spune că organismul mai bine organizate, mai multe grupuri de metil conținute în sale capac-structuri [2]. Cap 4 a fost detectat în unele dintre cele mai simple [6]. 2,2,7-trimetilguanozinovy capac caracteristic RNAs mici nucleare și servește ca un semnal de transport și / sau păstrarea acestora în nucleul [4].
mecanism de restricționare
plafonarea enzime

Structura moleculei de riboză. care arată starea 2'-, 3'- și atomii de carbon 5 '
Plafonarea - procesarea ARN prim pas. Acoperirea are loc co-traskriptsionno în nucleu. când transcript sintetizat este de 25-30 nucleotide lungime [7]. Acoperirea este efectuată de trei enzime. ARN trifosfataza și guaniltransferazoy 7 metiltransferaza [8].
scindează ARN trifosfataza grupei γ-fosfat din nucleotidul 5 'terminal al transcriptului. Secvența de aminoacizi a trifosfatazică ARN variază considerabil între eucariotelor și este posibil să se aloce cel puțin două familii ale acestor enzime: (. Caracteristică celor mai simple fungi și virusuri, eucariotelor) ARN trifosfataza dependentă de cationi bivalenți, și trifosfatazică ARN, independent de cationi bivalenți ( caracterizat prin animale și vegetale) [9]. In drojdia Saccharomyces cerevisiae gena ARN trifosfataza codificat propriu CET1. în timp ce enzima bifuncțională sintetizat de mamifere care posedă trifosfataznoy ARN (domeniul N-terminal) și activitatea guaniltransferaznoy (domeniul C-terminal). Guaniltransferaza (drojdie genom codificat Ceg1) Transferă reziduu de GTP la GMP β-fosfat grup de nucleotide 5-terminal al transcriptului pentru a forma structura GpppN. Această reacție are loc în două etape, pentru a forma o enzimă intermediară (lizil-N) -GMF. 7-metil-transferază în toate organismele este codificată de o genă distinctă (Abd1 drojdie) [9]. Această enzimă catalizează transferul unui grup metil de la S-adenosylmethionine la Gppp-ARN, pentru a forma un Gppp ARN-7 m.
Comunicarea cu plafonarea transcriere
Co-transcripțional plafonare a fluxului de proces este asigurată de faptul că enzimele capping se leagă direct la domeniul fosforilată C-terminal al subunității mari a ARN polimerazei II [10] [11]. Domeniul C-terminal are o structură conservată evolutiv unic: constă dintr-un motive de aminoacizi repetitive Tyr-Ser-Pro-Thr-Ser-Pro-Ser [9]. Mai multe kinaze pot fosforila resturile de aminoacizi din domeniul C-terminal de. Trecerea de la inițiere a transcripției devreme la alungire este însoțită de fosforilarea Ser-5 de transcriere factor TFIIH [12]. In timpul cantitatea de transcripție a unei fosforilat Ser-5 este redusă și începe să domine fosforilată Ser-2 [9]. După fosforilarea ARN polimerazei II de Ser-5 a complexului de transcripție unește negativ factor de transcriere DSIF (Engl DRB sensibilitate factor de inducere.), Care, la rândul său, atrage al doilea regulator negativ - (. Engl factor de alungire negativ) NELF. Împreună, acești factori inhibă temporar în continuare transcripția pasaj. Domeniul Guaniltransferazny enzimă capping mamifere are o afinitate pentru domeniul C-terminal al ARN polimerazei II, fosforilat la Ser-5. In ARN polimerază se leagă de drojdie guaniltransferaza Ceg1, care apoi atras la complexul trifosfatazică ARN CET1. În plus, guaniltransferaza comunică simultan cu una din subunitățile factor DSIF. Legarea formei fosforilate a ARN polimerazei și DSIF guaniltransferazy stimulează activitatea catalitică [13]. Interacțiunile descrise permit trecerea plafonare la scurt timp după inițierea transcrierii și înainte de complex de transcriere se va muta la o alungire productivă. Se crede că o fosforilate Ser-5 dispare de timp ca transcript atinge o lungime de 500 nucleotide. Până în acest moment al disociaza complexe de transcriere și plafonarea enzimei [12]. Este important de remarcat faptul că nu numai că determină cursul de plafonare transcriere, dar, de asemenea, succesul procesului de acoperire are un impact asupra cursului în continuare a transcrierii (vezi. De mai jos).
Plafonarea capătul 5“al transcriptul ARN determină în mare măsură soarta lui într-o celulă. Funcții capac cunoscute:
- Regulamentul de transcriere;
- participa la despicare;
- implicat în prelucrarea capătului 3 'al ARNm;
- reglementarea transportului ARN între nucleu și citoplasmă;
- Protecția transcript de degradarea prin exonucleaze;
- stimularea traducerii.
Regulamentul transcriptie
Se crede că mișcarea este inhibată complex de transcripție și factori de transcripție DSIF NELF, care acționează ca o pereche, și recuperează sub acțiunea unui regulator pozitiv PTEFb, care fosforilează motive de aminoacizi repetitive din domeniul C-terminal al ARN polimerazei II la poziția Ser-2 [13]. Mai multe grupuri de cercetători, sa constatat că transcrierea genelor în drojdii stimulate plafonare enzimei [18] [19] [20]. Sa constatat că acțiunea acestor enzime, transcriere nu se schimba, chiar dacă acestea sunt inactive catalitic din cauza mutațiilor. Acest fapt sugerează că simpla prezență a plafonarea enzimelor în complexul de transcripție, și nu neapărat chiar plafonare structura, stimulează circulația complexului de transcripție. Efectul stimulator al plafonare enzimelor, transcripția poate fi explicată, în primul rând, faptul că ei sunt capabili de a se lega la DSIF, deplasarea NELF dintr-un complex cu ei, astfel încât efectul inhibitor asupra DSIF transcripție terminată. [19] În al doilea rând, 7-metiltransferazei (cel puțin în cazul și elegans Schizosaccharomyces pombe Caenorhabditis at) se pot angaja în transcripție complex PTEFb factor de transcriere care promovează în partea de sus in promovarea genei complexe [21] [22]. Mai mult, o atracție suplimentară asigură PTEFb de legare capac complex de proteine (CBC) (cm. Mai jos) [23].
În același timp, există dovezi că transcrierea este, cel puțin unele dintre gene de drojdie are loc independent de plafonare. [13] Aceasta este, cel puțin în transcriere drojdie și plafonarea legătură este o caracteristică genă. Studii suplimentare ar trebui să arate dacă acest lucru este cazul cu alte organisme.
Participarea la despicare
Structura Cap încurajează pre-despicare mRNA ca in vitro. si in vivo. mai mult decât atât în mare măsură stimulate prin excizia intronilor cel mai aproape de capătul 5 'al [24] [25] [26] transcrierea. Efectul pozitiv al capacului pe despicare este explicată după cum urmează. Imediat după aderarea la capacul la capătul 5 'al transcriptului lui (complex ing. Cap de legare) legat de legare capac complex CBC, ceea ce este important pentru etapele ulterioare ale procesării pre-ARNm. CBC este compus din două subunități: a (proteina de legare capac Engl.) CBP20-legare capac Și CBP80 auxiliar [27]. Cap interacționează complexe de legare cu una din componentele spliceosome. snRNPs U1, și oferă aterizare asupra pre-ARNm aproape de capătul 5 '. snRNPs U1 este responsabil pentru recunoașterea site-ul splice-5'terminală, adunarea ulterioară a spliceosome începe cu el. [28] Trebuie remarcat faptul că, la fel ca în cazul de transcriere, dar nu se știe în ce proporție pre-ARNm despicare care nu depinde de prezența capacului, în diferite organisme. Oricum, se arată că această dependență este o genă specifică în S. cerevisiae [13].
Participarea la prelucrarea capătului 3 'al ARNm
Capătul 3 „al ARNm eucariot este format în două etape: mai întâi un anumit endonucleazică face decalaj la porțiunea 3 'terminală a ARNm și apoi poli (A) polimerază se atașează la nou format 3“ coadă capătul poli (A) [29]. capac Disponibilitate stimulează clivaj al endoproteolytic capătul 3 'al ARNm în extractele nucleare de celule HeLa [30] [31]. Efectul pozitiv al capacului, în acest caz, se realizează și prin complexul de legare capac care se leagă la 3 'componente ale complexului de prelucrare și asigură stabilitatea acestuia [32]. Are prezența capacului asupra eficienței poliadenilare nu a fost încă stabilită.
Rolul în transportul ARN
Cap de transport joacă un rol important de ARN din nucleu. ARNm export este complex care implică factori de transport Mex67-Mtr2 (drojdii) sau TAP-p15 (multicelulare) [33]. Cu toate acestea, acest complex se leagă la ARNm-ul nu direct, ci prin intermediul proteinelor adaptor Yra1 (drojdii) sau ALY / REF (multicelulare), care este una dintre subunități ale complexului proteic TREX. La rândul său, TREX implicat într-un complex cu ARNm datorită interacțiunii directe ALY / REF cu CBC80 subunitate capac de legare complex [34]. Acest mecanism de transport asigură aderența strânsă complex la capătul 5 'al ARNm și orientarea corespunzătoare a transportului său, în partea capătul 5' al citoplasmei.
ARN nuclear mic sintetizat prin ARN polimeraza II, exportate în citoplasmă pentru un timp pentru maturare ulterioară, și apoi vin înapoi în nucleu pentru a îndeplini funcțiile sale, în același timp, capacul reglementează transportul lor în ambele direcții. snRNA exportate când participarea proteina de transport Crm1, care, la fel ca în cazul ARNm se leagă de substratul său prin proteina adaptor PHAX (Engl. adaptor fosforilat pentru export ARN) [35]. PHAX se alătură snRNA datorită afinității lor pentru complexul de legare capac. În timpul formării în snRNPs citoplasmatici capping structura snRNA este dublu de metilare pentru a forma capac 2,2,7-trimetilguanozinovogo [4]. Alt factor de transport snurportin 1 recunoaște un astfel de capac modificat și asigură transportul snRNPs înapoi la nucleul [36]. Este probabil ca capac suplimentar de metilare previne, de asemenea export repetate sau aleator ARN din nucleu, și / sau revenirea lor în nucleu după mitoză.
Protejarea ARNm de degradare
Prezența capacului la capătul 5“al moleculei ARNm protejează de degradarea rapidă prin exonucleaze în două moduri [37] [2]. În primul rând, 5'-exonuclează nu se poate scinda 5“, 5'-trifosfat legătură între ARNm și corp acoperit. În al doilea rând, proteinele de legare la cap (de exemplu, eIF4E-eIF4G) blocând accesul nucleaze la capătul 5 'al ARNm [4]. Scindarea a capacului (dekepirovanie) este una dintre etapele cheie în unele degradarea ARNm moduri (vezi. De mai jos).
Rolul în difuzare
După finalizarea procesării ARNm urmează etapa de control al calității originale. Prin procesul de divizare a ARNm care conțin codoni stop prematuri (descompunere Engl. Nonsense mediată) (NMD) de celule scapa de ARNm, care poate fi sintetizat scurtat și, probabil, în imposibilitatea de a efectua proteinele sale funcții. ARNm matur care conține încă mai legând capac CBC complex, la capătul 5 'și alte proteine specifice pentru mRNP nucleare, implicat în prima rundă de testare de traducere. Dacă în timpul prezenței detectată premature codon de oprire a translației, astfel ARNm este degradat de calea NMD. Dacă un astfel de codon stop nu a fost, atunci există un înlocuitor de legare mRNA proteine specifice în citoplasmă (de exemplu, PABP2 înlocuit cu PABP1, CBC - pe eIF4E) și devine ARNm pentru traducerea matricei full [38].
Majoritatea ARNm eucariot se traduce printr-un mecanism dependent de capac și numai o proporție relativ mică din ele - prin intermediul mecanismului de aterizare ribozom intern. Relativ fost mult timp cunoscut faptul că nekepirovannye ARNm sunt șabloane slabe pentru sinteza proteinelor in experimentele in vitro, că prezența capacului și stimulează legarea ARNm la ribozomului [2]. Până în prezent, este cunoscut mecanismul molecular al acțiunii a capacului. Inițierea traducere dependentă de capac include etapa de asamblare eIF4F complex (eIF4E-eIF4G-eIF4A) plafonat la capătul 5“al ARNm. Primul este conectat la ARNm capac de legare factor de inițiere a translației eIF4E, care atrage o proteina complex mai mare eIF4G. eIF4G, la rândul său, servește ca o platformă pentru plantare alte proteine: eIF4A, eIF3 și PABP. Efectul acestora și încă alte proteine pregătesc ARNm pentru plantare preinitsiatornogo complex 43S conținând subunitatea mică a ribozomului. Aceasta este urmată de scanare a subunității mici ribozomale regiunea 5'-netradusă a ARNm pornind de la capătul 5 ', căutarea codon start și începutul sintezei proteinelor [39] [40].
Dekepirovanie și rekepirovanie
Dekepirovanie
Cap împreună cu poli (A) coadă asigură stabilitatea moleculei ARNm și scindarea capacului conduce la degradarea acesteia. Astfel dekepirovanie este critică în ciclul de viață al ARNm și este strict reglementată în celula [41].
Există mai multe moduri posibile de ARNm eucariot degradare [42]:
- degradarea, scurtarea dependentă de poli (A) coadă;
- 5 „→ 3 'degradare;
- 3 „→ 5'-degradare;
- degradarea nu este scurtarea dependentă de poli (A) coadă;
- degradare când endonucleazelor soarta.
In cazul scurtării dependente de poli (A) coada de evenimente de degradare a ARNm-ar putea dezvolta în două scenarii nu se exclud reciproc. Clivajul la „→ 3“ 5 începe cu ARNm sub dekepirovaniya dekepiruyuschego komplkeksa proteină. În S. cerevisiae, acest complex este format din două proteine: subunitatea catalitică Dcp2 (ing.) Rus. și co-activator Dcp1 (Eng.) Rusă. In eucariotele superioare, acest complex include o a treia proteină, numită Hedls (umană), care asigură o legătură suplimentară între subunitățile complexului și stimulează dekepirovanie [41]. Produsele de reacție sunt dekepirovaniya 7-metil-GDF și ARN cu monofosfat la capătul 5 '. O astfel de capătul 5 'devin disponibile ekzoribonukleaze Xrn1 (Eng.) Rusă. care distruge mARN în „→ 3“ 5. Proteinele implicate în 5 „→ degradarea 3'-ARNm se găsesc în cantități mari în corpusculii de procesare (Eng.) Din Rusia. Este considerat ca un posibil loc de depozitare și / sau degradarea ARNm [42].
Distrugerea ARNm în „→ 5“ exonucleazică 3 catalizate cu subunități multiple mai mare - exosomes (ing.) Rus. Plafonată oligonucleotide di- sau, care rămâne după finalizarea exosomes dekepirovaniyu suferă sub acțiunea enzimei DCPs (Eng.) Din Rusia. pentru a da 7-metil-GMP. DCPs De asemenea, convertește 7-metil-PIB, care este format de ARNm dekepirovanii sub dekepiruyuschego complex, 7-metil-GMP [4].