Proteinele de soc termic (HSPs). Efectele răspunsului imun înnăscut la HSP-uri
proteine de șoc termic (proteine Shok caldura HSPs) sunt larg răspândite în natură și sunt una dintre moleculele biosferă mai conservate. Funcția primară a HSP-urilor - protecția sistemelor biologice de efectele daunatoare ale stresului. În evoluția eucariotelor unele HSPs au dobândit caracteristici care le-a permis să se integreze în sistemul de imunitate.
Rolul HSPs în mecanismele de interacțiune a imunității înnăscute și dobândite depinde de capacitatea de a intercepta HSPs și peptide antigenice le reprezintă folosind DC T-limfocite în contextul moleculelor MHC.
Proteinele de șoc de căldură oferă funcții importante de viață și prezentate în toate organismele vii. produse de gene, pentru a numi proteine de șoc termic sau proteine de stres celulare produse într-o hipertermie, au fost inițial identificate ca fiind molecule produse ca răspuns la prezența în celulele de proteine misfolded. Apoi, sa constatat că HSP-urile joaca rolul de chaperones într-o asamblare și dezasamblare a altor structuri macromoleculare non-covalentă, cu toate că acestea nu sunt componente permanente ale acestor structuri în îndeplinirea funcțiilor lor biologice.
Proteinele de șoc termic de reacție nu sunt fixate numai în condiții de hipertermie, dar, de asemenea, în condiții de stres oxidativ, acidoza, ischemie, hipoxie, hyperoxia, epuizarea energiei celulelor și t n. In aceste conditii, HSPs sunt eliberate din celulele necrotice în distrugerea țesutului sau liza celulelor infectate.
Datorită recunoașterii special a secvențelor de aminoacizi hidrofobi pe suprafața proteinelor ca un semnal de avertizare de conformationala instabilitatea lor, HSPs sunt în măsură să pună în aplicare astfel de funcții vitale ca parte în asigurarea organizării spațiale a moleculelor de proteină (condiții de pliere), stabilizarea acestora, corectarea modificărilor conformaționale proteine (reîmpachetare) translocatie prin membranele de organite intracelulare, prevenind degradarea proteinelor și agregarea proteinelor instabile. În același timp, HSPs prezintă activitate anti-apoptotice. In total, HSPs acționează ca un sistem tampon, contracara stocastică și factori potențial destabilizatoare ale mediului celular.
HSP-urile joacă un rol important în inducerea răspunsului imun, în special a sistemului imunitar înnăscut: crește activitatea celulelor NK, APC maturarea si producerea de citokine. fragmente peptidice de molecule de proteine fisionabile interceptat HSPs și, eventual, în curs de procesare în răspunsul APC indus imunității adaptive. Astfel, prin activarea APC și antigenul implicat în procesarea proteinelor de șoc termic integrează reacțiile înnăscute și dobândite (adaptive) imunitate.
Proprietățile imunostimulatoare prezintă HSP pro și eukariticheskogo origine. Capacitatea de a induce un răspuns imun au reprezentanți ai mai multor familii de HSP (calreticulin, hsp10, hsp60, HSP70, HSP90, Hsp 100 și HSP170).
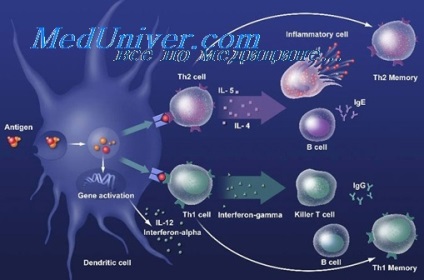
Funcția Chaperone de proteine de șoc termic se realizează nu numai în biogeneza altor proteine, dar, de asemenea, în răspunsul imun la antigeni. Schimbările de mediu la infecția creează o situație de stres pentru agentul patogen invadator, sau pentru o celulă gazdă, care se manifestă prin intensificarea reciprocă a sintezei și activității funcționale a proteinelor de șoc termic. Chaperones moleculara de bacterii servesc ca liganzi pentru receptorii de pe suprafața celulelor gazdă.
HSP-urile pot fi recunoscute de TLR2, TLR4. Alte dr96, HSP90 și HSP70, interacționează cu celulele prezentatoare de antigen printr-un receptor comun, CD91. peptide HSP-chaperon pătrunde în macrofage / celule dendritice prin CD91, prelucrate și sunt prezentate împreună cu MHC I și MHC II. Acest lucru determină activarea CD4 și celulele T CD8. HSP-DC prin interacțiunea CD91 conduce la maturizarea celulelor dendritice și secreția de citokine.
Interacțiunea tuberculozei M recombinant HSP 70 cu TLR-2 și TLR-4 in vitro a declanșat cascada de semnalizare care implică proteinele adaptor MyD88, TIRAP, TRIF si Tram in celulele endoteliale umane și macrofage la șoareci este un factor de activare a NF-kV transcriere.
Introdusă în reticulul endoplasmic al chaperone eucariot GRP94 / gp96 prin interacțiunea cu TLR-2 și TLR-4 activeaza celulele dendritice pentru a iniția răspunsul limfocitelor-T CD8“. Astfel, expresia moleculelor MICA / B care interactioneaza cu receptorul NKG2D prezentat pe suprafața celulelor CD8 îmbunătățită, dar nu CD4 * celulele T. În interacțiunea HSP70 cu TLR7, este secretat în mod activ și eliberat atunci când moartea necrotică a celulelor de mamifer este îmbunătățită fagocitare a macrofagelor. Acest efect este afișat pentru câteva minute și se exprimă nu numai în stimularea fagocitozei, dar, de asemenea, funcția de prezentare a antigenului celulelor T prin intermediul căilor de semnalizare mediate de phosphoinositide 3-kinazei și p38 MAP kinazei.
Într-o prezentare a antigenului de realizare a celulelor T-helper participă, de asemenea, limfocitele B mature care exprimă TLR-2 și TLR-4. Ele răspund la LPS, peptidoglican, HSP60 expresia crescută MHC II și molecule costimulatoare. Human HSP 60, dar nu GroEL E. coli sau HSP 65 M. tuberculosis proliferarea indusă de șoareci naivi celulelor B și secreția de IL-6 și IL-10.
Astăzi, mulți receptori. recunoscând modele cunoscute PAMPs procariote, fungi, virusuri, patogeni protozoare nu sunt încă caracterizate. Există o relație între fagocitoza și expresia TLR, deoarece semnalele de activare prin TLR îmbunătățește procesele fagocitare și modulează secvență de activare fagocitoza TLR.
Este evident faptul ca modelele moleculare chiar nedefinite pot denatura sau direcționa răspunsul imun adaptativ pe tipul Th-2 este posibil ca absența semnalelor (de exemplu - PAMPs), cum ar fi deficiența lor MHC I pentru activarea celulelor NK este un stimulent pentru a rula al doilea tip de imunitate.
Inducerea de semnalizare prin intermediul receptorilor Toll-like pot oferi nu numai o protecție a organismului împotriva diferitelor infecții. Violarea de conducere a semnalului de date funcția duce la dezvoltarea unui număr de procese patologice în organism. De exemplu, producția excesivă de citokine proinflamatorii de către liganzi endogeni pot determina dezvoltarea inflamației cronice, boli autoimune, cum ar fi boala lui Crohn, diabetul zaharat de tip 1, ateroscleroza. Modificarea echilibrului în favoarea citokinelor proinflamatorii, probabil datorită dezvoltării de edem local și reacții inflamatorii în SNC inițiate de citokine proinflamatorii (TNF-a sau IL-1P). În formarea tulburărilor de lungă durată neurologice care implică mai multe citokine care potențare producerea și acțiunea reciproc, sunt stocate în circulație lung.
Prezența constantă a citokine sprijină inflamația cronică în sistemul nervos central, însoțit de demielinizare, iar în unele cazuri și moartea neuronilor.