Formula structurală a acidului sulfuric are următoarea formă:
Proprietățile fizice ale acidului sulfuric
sulfat Acid - este un lichid incolor, greu, uleios, care îngheață la o temperatură de 10 ° C și se fierbe la o temperatură de 296 ° C (soluție de 98,3% la fierbere, iar excesul de acid sulfuric este descompus în anhidridă sulfat și apă). Densitatea acidului sulfuric la +20 ° C, este de 1,84 g / cm3 100% sulfat de acid greu conduce electricitatea. Soluție de acid sulfuric 95% se cristalizează la o temperatură mai mică: -20 ° C
Acest compus este foarte higroscopic, adică capabil să absoarbă umezeala din mediul înconjurător. În acest caz, o cantitate mare de energie termică. Dacă apa umple din nou la acidul sulfuric poate fi eliberată atât de multă energie încât acidul fierbe si incepe sa se pulveriza pe părțile laterale, astfel încât, în scopul de a dilua un acid sulfat concentrat, ar trebui să se adauge acidul în porțiuni mici în apă.
Acid sulfatată capabil să dizolve aproximativ 65% anhidridă sulfat SO 3. Aceasta formează oleum.
Proprietățile chimice ale acidului sulfuric
Acid sulfatată este o okisnikom foarte puternică. În soluții diluate de oxidare trece prin lege și este hidrogen, și în soluții concentrate - datorită atomului de sulf (V S).
Proprietățile acide ale acidului sulfuric
Acid sulfat - este unul dintre cei mai puternici acizi. În soluții diluate, este diacidul care suferă de disociere la schema:
acidul sulfatată, precum și sulfit, formează două serii de săruri. Acestea includ sulfați (de exemplu, BaSO 4 - sulfat de bariu) și gіdrogensulfati (NaHSC 4 - gіdrogensulfat de sodiu). Acid sulfatată reacționează puternic cu baze diferite și oxizi de bază, sulfați astfel formate:
Acesta reacționează cu metale și care este deplasat într-o serie de potențiale standard de electrod la hidrogen:
Dar, cu sulfat de fier de acid (≥ 75%) nu reacționează concentrat, astfel încât este de obicei transportată în butoaie din oțel și tancuri. sulfat de acid nu reacționează cu plumb, și, de asemenea, deoarece suprafața metalică este acoperită cu un plumb insolubil peliculă solidă sulfat (II) PbSO 4. iar acest proces se oprește.
Proprietățile de oxidare a acidului sulfuric
În soluții concentrate, acid sulfat când este încălzit reacționează cu multe metale, chiar și unii dintre cei care sunt în seria electrochimică subliniază dreptul hidrogenului:
Produse de recuperare a acidului sulfuric stocate în aceste reacții nu sunt singurele. In general, toate aceste reacții, un amestec de H2 S. S. SO 2. care structura depinde de multe condiții (concentrația de acid, temperatura amestecului, suprafața metalică de suprafață, etc.), dar produsul a înregistrat acestea au predominant.
Când, acid sulfat concentrat încălzit reacționează bine cu multe nemetale:
Acid sulfatată oxideaza mulți compuși complecși:
Majoritatea compușilor organici, se desparte moleculele de apă, ceea ce duce la carbonizarea conexiunii. De exemplu, în cazul în care hârtia a pus o picătură de acid sulfuric, în câteva secunde, o pată neagră se formează în locul picaturile, constând din carbon:
Înțeles acid sulfuric în economie
Acid sulfatată - produs important al industriei chimice. Producția mondială de acid sulfuric cu un an se ridică la sute de milioane de tone.
Acid Sulfatul este utilizat pentru a produce o varietate de acizi volatili, de exemplu, acid clorhidric, acid acetic, ortofosfat, azotic și alții, precum și pentru producția de îngrășăminte azotate și fosfatice (superfosfat, fosfat de amoniu, etc.). acidul sulfatată este esențială în producția de materiale plastice, hârtie, materiale de construcții, textile, vopsele si detergenti. Utilizarea sa pentru purificarea petrolului, produse petroliere și producția de cocs (benzenu și toluen) de la contaminanți. Pentru producerea de esteri, anhidride, acizi organici, și, de asemenea, necesar de acid diferit sulfopohіdnih sulfat. În industria oțelului este folosit pentru curățarea suprafețelor metalice înainte de acoperire. Soluție de sulfat de acid este utilizat ca electrolit în acid baterii.
acidul sulfatată este indispensabilă în gospodărie.
Acid sulfuric
sulfat de acid extras prin două metode diferite: un contact și azot. Indiferent de metoda de obținere, întotdeauna trei etape principale:
- obținerea acidului sulfuric.
anhidridă Sulfit SO 2 este produs prin ardere, de obicei, pirita (FeS2) ca un produs secundar de fier de topire. In schimb pirita folosesc, de asemenea, alte sulfura (CdS. ZnS) sau hidrogen sulfurat recuperat din petrol și gaze naturale, sau obținute prin cocsificarea cărbunelui. Uneori folosesc un simplu sulf substanță.
Metoda cu acid sulfuric de contact
Înainte de pirită prăjire este pulverizat pentru a accelera arderea. Pentru a mări randamentul de sulfit anhidridă de cuptor pirită excesul de oxigen alimentat suplimentar. Trece acest răspuns:
Schema unei instalații industriale pentru producerea de acid sulfuric prin metoda de contact este prezentată mai jos:
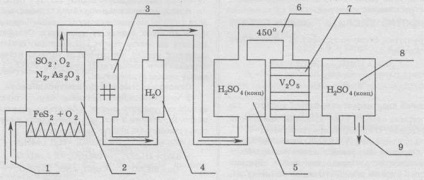
Procesul funcționează această setare asta este. Cuptorul (2) este ars pirita. Oxigenul pentru combustie este alimentat prin conducta (1). Deoarece pirita minerale naturale a conținut aproximativ 20% din impurități, apoi, după ardere, desigur, să fie, de asemenea, gazele de impurități. O astfel de impuritate este arsenul oxid (III). Acest lucru în sine este cea mai periculoasă substanță pentru mediu este o otravă de catalizator, care este, încalcă catalizatorul. Pentru a elimina acest amestec gazos de impurități nedorite este trecut printr-o filtre electrice speciale (3) și spălarea cu turn de apă (4). După spălarea amestecului cu apa devine umed, și apă pentru îndepărtarea impurităților, amestecul a fost trecut printr-o coloană cu acid sulfuric concentrat (5), care absoarbe umezeala. Mai mult, amestecul gazos este încălzit într-un schimbător de căldură (6), la o temperatură de 450 °, iar amestecul intră contactorului (7), în care catalizatorul este un V 2 O 5 (ca un catalizator folosit uneori ca vanadil sulfat VOSO 4. platină sau argint). După aceea, trioxid de sulf format a fost dizolvat în acid sulfat concentrat (8), formând astfel oleum, care umple rezervorul prin retragerea produsului final (9).
Metoda Nіtrozny de obținere a acidului sulfuric
acid sulfuric 20%, care este produsă în lume este produs nitros sau turn, metoda. În această metodă, oxidarea SO 2 SO 3 se efectuează de dioxid de azot NO 2.
Bioxidul de azot în această metodă este regenerat cu aer și oxigen reintră în reacția de oxidare a sulfului (I V) oxid de: