Electroliții sunt substanțe care sunt într-un comportament de energie electrică topit sau dizolvat.
El a dezvoltat teoria disocierii electrolitice Svante Arrhenius. El a propus o teorie pentru a explica comportamentul și proprietățile multor electroliți.
Conform acestei teorii a moleculelor de electroliți în apă sau alt mediu, caracterizat prin mare * dielectric constant, disociază în ioni - pozitivi (cationi) și negativi (anioni).
Procesul de dezintegrare a materiei în ioni se numește disociere electrolitică. Pentru electroliții slabi, se pornește și se exprimă prin reversibil următoarea ecuație aproximativă
Prin electrolitii includ acele molecule în care atomii legați legături chimice puternic polari sau ionice.
Conform conceptelor moderne de disociere electrolitica în soluție este un rezultat al interacțiunii fizico-chimic complex cu molecule polare ale electroliților moleculele de solvent.
Interacțiunea ionilor cu moleculele de solvent polar numite solvatare (pentru soluții apoase - hidratare) ioni. Solvarea conduce la formarea de asociații între ionii de soluție (cationi și anioni) și molecule de solvent. Procesul de dizolvare a substanței K + A- în apă, care este un compus tipic de legătură ionică, poate fi scrisă astfel:
.
mortar solid
O disociere electrolitică a moleculelor polare de comunicație (KA) se datorează atenuării în soluția cauzată de acțiunea moleculelor de solvent polare:
KA + xH2O <=> K + (H2O) la A + (H2O) a.
Asociația K + (H 2 O) k și A- (H2O) și sunt cationi hidratați și anioni.
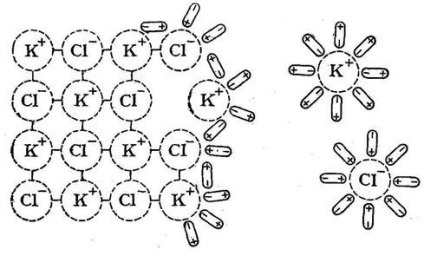
La fel de important este constanta dielectrică a solventului: cu cât ultima, cu atât mai mare legătura slăbită dintre ionii de electrolit. Acest lucru rezultă din formula de legea lui Coulomb
, unde F - forța dintre L1 și L2 taxe, r distanța dintre centrele ionilor, # 949; - constanta dielectrică a solventului. Pentru apă la 20 ° C # 949; = 80, adică forța de atracție a ionilor în soluția apoasă este redus de 80 de ori.
În cazul în care soluția poate rezulta, în plus, de asemenea, legături de hidrogen între moleculele de solvent și atomul de hidrogen al unui solut, procesul de disociere pornește mai eficient.
Din punct de vedere al disociere electrolitica se numește compus de acid disociază în soluție apoasă, pentru a forma un ionii hidratați de hidrogen (ioni hidroniu) și fragmentul de acid:
,
în care H3O + - ion hidroniu.
Toate proprietățile acizilor generale (gust acid, capacitatea de a schimba indicatorii de culoare, etc.) aparțin ionul hidroniu.
Motivul pentru care se numește compus disociază în soluție apoasă, pentru a forma un hidroxid negativ ioni OH-:
MeOH + xH2O <=> Me + (H 2 O) k + OH- + (x-k) H2O
în cazul în care Me + - un cation monovalent.
Toate proprietățile generale baze solubile (alcaline săpun gust, capacitatea de a modifica indicatorii specifici de colorare etc.) aparțin unui ion hidroxid.
Din punct de vedere al disocierii electrolitice a sării poate fi considerată ca fiind produsul de reacție al acidului si bazei:
x (acid) + y (bază) → sare + apă,
unde x și y - un număr variabil de echivalenți de interacțiune acizi și baze.
În funcție de raportul dintre x și y din următoarele tipuri de săruri care se disociază în soluții apoase conform schemei:
când x> y - sărurile acidului
2H2SO4 + Mg (OH) 2 ® Mg (HSO4) 2 + 2H2O;
Mg (HSO4) 2 <=> Mg2 + + 2HSO4-;
atunci când x = y - medie de sare (normal)
H2SO4 + Mg (OH) 2 ® MgSO4 + 2H2O;
MgSO4 <=> Mg2 + + SO42-;
la x <у – основные соли
H2SO4 + 2mg (OH) 2 ® (MgOH) 2SO4 + 2H2O;
(MgOH) 2SO4 <=> 2MgOH + + SO42-;
Ca regulă generală, toate sărurile sunt electroliți puternici.
electroliți puternici complet disociat în ioni în soluții apoase.
Apa este solvent, statistic uniform distribuite cationi hidratat și anionii unui electrolit puternic. interactiunea electrostatica dintre ionii se reduce la minimum, prin distanțe mari între ele și rolul de ecranare performant de hidratare coajă.
Spre deosebire de electroliți puternici disocierea electroliții slabi apare și se stabilește în mod reversibil echilibrul.
proces de disociere Cantitativ pot fi descrise valori următoarele: un grad de disociere electrolitica a unei, disociere electrolitica constantă K și colab.
Gradul de disociere electrolitică a unui - este raportul dintre moleculele dezintegrată în ioni, numărul total de molecule de solut în soluție.
o poate fi măsurată în fracțiuni de unități sau ca procent. a = 0, dacă disocierea este absent; a = 1 sau a = 100% la disociere deplină a electrolitului.
Prin procesul de disociere electrolitica, ca un proces reversibil, este posibil să se aplice principiul Le Chatelier și identifică influența factorilor externi asupra stării de echilibru, având ca rezultat o modificare a valorii a.
Pentru deplasarea echilibrului
K + A + xH2O <=> K + (H 2 O) k + A (H2O) și
de la stânga la dreapta, adică în direcția de disociere, este necesar să se mărească greutatea solventului. Acest lucru înseamnă că:
disocierea electroliților slabi se extinde efectiv diluat decât în concentrat. Cu alte cuvinte, o crește odată cu scăderea concentrației de electrolit în soluția și ia valoarea maximă A = 1 într-o soluție diluată la infinit.
deoarece disociere este un proces endoterm, gradul de disociere a unui electrolit slab în soluția apoasă va crește odată cu creșterea temperaturii.
disociere electrolitica constanta K este o constantă a echilibrului chimic în soluția electrolitică:
,
unde [K +] [A-] și [KA] - concentrația ionilor în soluție
(Gram-ion / litru) și SC nedisociat compuși (mol / l).
Pentru mai mult, cu atât mai bine electrolitul descompune în ioni. Pentru un anumit electrolit valoare constantă K, la o anumită temperatură și, spre deosebire de o este independentă de concentrație.
Comunicarea între o constantă K și un grad de disociere poate fi găsit după cum urmează. concentrația ionilor de K + și A- în soluție este egală cu
unde C - concentrația molară inițială; un - grad de disociere electrolitică a electrolitului. Concentrarea SC molecule nedisociate în soluție este egală cu
.
Această ecuație exprimă legea de diluare.
Dacă un este mic, atunci o 1- ≈ 1 și apoi
.
Se poate observa că odată cu scăderea concentrației de electrolit în soluția crește gradul de disociere electrolitic.
Disocierea electrolit slab, a cărui moleculă nu se poate disocia la două, și un număr mai mare de ioni (electroliti ioni heterovalent), are loc în etape (etapa de disociere). De exemplu, în cazul în care slab carbonic disocierea H2CO3 acidă în soluție apoasă au următoarea poziție de echilibru:
Etapa I: H2CO3 <=> H + + HCO3-
.
Etapa II: HCO3- <=> H + + SO32
.
După cum se poate observa din aceste date, un proces electrolitic de disociere slab ioni heterovalent mai ales primul stadiu determinat.
De exemplu, să constantele de disociere electrolitice ale anumitor acizi și baze slabe (25 ° C):
Reacțiile în soluțiile electrolitice, în care are loc nici o schimbare în sarcina ionilor incluși în compușii menționate reacții schimbătoare de ioni.
Regula Berthollet: echilibru în reacția de schimb ionic este deplasată spre formarea mai puțin compușilor disociați.
Prin urmare, direcția reacțiilor de schimb ionic se determină prin următoarea regulă de degetul mare: reacții ionice continua spre formarea de precipitare, gaze, electroliti ioni slabi, complexe.
Când scrieți ecuații reacții ionice electroliți puternici sunt scrise într-o formă disociată, slab - în nedisociat.
AgNO3 + NaCl ® AgCl¯ + NaNO3
Solutia: Ag + + NO3- + Na + + Cl- ® AgCl¯ + Na + + NO3-.
Excludeți ionii care nu interacționează, atunci ecuația are forma:
Ag + + Cl- ® AgCl¯.
Ecuațiile de acest tip sunt cunoscute ca ion.
ecuația Ion obținerea hidroxidului feric este scris după cum urmează:
Fe3 + + 3OH- ® Fe (OH) 3¯.
Na2S + H2SO4 ® H2S- + Na2SO4;
2Na + + S2- + 2H + + SO42- ® H2S- + 2Na + + SO42-;
Educație electroliți slab:
a. formarea de apă. Reacție care are loc pentru a forma apa prin reacția ionilor de hidrogen (de fapt, ionii de hidroniu) și ioni de hidroxid, numita reacție de neutralizare.
NaOH + HCI ® H2O + NaCl
în. formarea unei baze slabe.
NH4 + + Cl- + K + + OH- ® + K + NH4OH + Cl-
a. formarea unui acid slab.
2SH3COO- + 2Na + + 2H + + SO42- ® 2CH3COOH + 3NA + + SO42-
CH3COO- + H + ® CH3COOH.
Produsul ionic al apei
Procesul de disociere electrolitica a apei are loc în două etape: 1. formarea ionilor de hidrogen și ioni de hidroxid:
2. Hidratarea ioni de hidrogen pentru a forma un ion hidroniu:
H + + H2O <=> H3O +.
Prima etapă a procesului are loc cu absorbție de căldură, al doilea - cu eliberarea unei cantități semnificative. Prin urmare, aproape toți ionii de hidrogen sunt hidratați și disocierea apei trebuie să fie reprezentată de următoarea ecuație:
2H2O <=> H3O + + OH-.
La 22 ° C, gradul de disociere electrolitica a apei este de 1,8 x 10-9, adică de la 555 000 000 de molecule de apă se disocieze una. Prin urmare, apa - electrolit foarte slab, și pentru a descrie procesul de disociere sa este legea aplicabilă acțiunii în masă:
,
unde K - constanta de disociere a apei.
Deoarece [H2O] = const, obținem:
KW constantă numită produsul ionic al apei.
La 1 litru de apă, greutatea care pot fi luate pentru a fi de 1000 g, este de 1000 g / 18 g = 55,5 mol de substanță (concentrația sa molară).
În consecință, la 22 ° C, concentrația ionilor de hidroniu și ionii de hidroxid sunt:
[H3O +] [OH-] = 55.5 · 1.8 · 10-9 = 1,000 · 10-7 g ion / litru.
Dimensiunea KW crește odată cu creșterea temperaturii, deoarece acest lucru crește gradul de disociere electrolitica:
. La temperatura camerei accepta valoarea rotunjită a produsului ionic al apei 10-14.
Soluțiile apoase ale diferiților compuși pot produce acide, alcaline sau reacție neutră. Mediul de reacție depinde de raportul dintre concentrația ionilor de hidroniu si ioni de hidroxid în soluție.
În cazul în care concentrațiile acestor ioni sunt egale, adică [H3O +] = [OH-], mediul de reacție este neutru. Prin urmare, apa aparține compuși obișnuiți amfoteri care combină proprietățile acide și bazice, exprimat în același grad.
În cazul în care concentrația ionilor de hidroniu mai mare concentrație de ioni de hidroxid, adică [H3O +]> [OH-], mediul de reacție devine acidă. Aciditatea este mai mare, cu atât mai mare concentrația ionilor hidroniu. Dacă în schimb, concentrația de ioni de hidroniu mai mică decât concentrația de ioni de hidroxid, adică [H3O +] <[ОН-], то реакция среды становится щелочной. Следовательно, по значению концентрации этих ионов можно количественно охарактеризовать реакцию среды.
Aciditatea sau bazicitatea soluției poate fi exprimată prin luarea concentrației de ioni de hidrogen in loc de logaritm sale. Pentru a scăpa de puterea negativă în valoarea concentrației ionilor de hidrogen, se propune să se utilizeze o valoare negativă a logaritmului valorii [H +], numita valoare pH sau pH:
luate Kw = 10-14 (22 ° C) în practică, aici [H +] = 10-7 g ion / l și pH = 7.
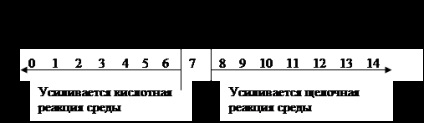
Raportul dintre mediul de reacție, concentrația de ioni și valorile indicelui de hidrogen se obțin după cum urmează:
mediu neutru [H3O +] = [OH-] = 7,10 g ioni / L, pH = 7.
mediu acidic [H3O +]> [OH -]> 10-7 g-ion / l, pH <7.
alcalină [H3O +] <[ОН-] <10-7 г-ион/л, рН> 7.
Acest lucru poate fi reprezentat prin schema:
Hidroliza - interacțiunea ionilor cu apa sarata, având ca rezultat formarea unui electrolit slab.
Dacă sarea este considerată ca produs de reacție acidă cu o bază, în funcție de puterea lor toate sărurile pot fi împărțite în patru tipuri conform schemei.
IV: CH3COONH4, Al2S3
Sărurile primul tip nu sunt supuse hidrolizei, deoarece ele interacționează cu electroliți slabi de apa nu pot fi obținute. Sistemul H2O ↔ H + + OH- echilibru este perturbat. PH-ul în soluțiile acestor săruri este egal cu 7.
Luați în considerare hidroliza celor trei tipuri rămase de săruri. Sărurile formate de acizi mnogokislotnymi polibazici sau baze, în trepte hidrolizată, se deplasează într-o primă fază la săruri acide sau bazice.
Pasesc 2Na + + CO32- + HOH <=> Na + + HCO3- + Na + + OH-
CO32- + HOH <=> HCO3- + OH-;
Etapa II Na + + HCO3- + HOH <=> H2CO3 + Na + + OH-
HCO3- + HOH <=> H2CO3 + OH-.
Hidroliza Na2CO3 și alte săruri ale acestui tip se acumulează ioni OH- în soluție, informându-l pH alcalin> 7. exprimat puternic decât prima etapă de hidroliză decât a doua.
Nivelul I: Zn2 + + 2Cl- + HOH <=> ZnOH + + Cl- + H + + Cl-
Zn2 + + HOH <=> ZnOH + + H +;
Nivelul II: ZnOH + + HOH + CI- <=> Zn (OH) 2 + H + + Cl-
ZnOH + + HOH <=> Zn (OH) 2 + H +.
Hidroliza ZnCl2 și alte săruri ale acestui tip se acumulează în soluție ionii H +, informându-l reacționat cu un pH acid <7.
NH4 + CH3COO- + HOH <=> + NH4OH CH3COOH.
Sărurile de acest tip sunt relativ ușor de hidrolizat. Soluția de reacție și pH-ul este determinat de puterea relativă a bazelor și acizilor rezultante. În cazul disocierii electrolitice constantele și CH3COOH NH4OH la 25 ° C, sunt, respectiv, 1,79 · 10-5 și 1,76 · 10-5, și, prin urmare, soluția de reacție este aproape neutru (pH = 7).
Sărurile, procesul de hidroliză poate fi descrisă cantitativ prin două variabile: gradul de hidroliză h, hidroliza constantele Kgidr.
Gradul de hidroliză este raportul dintre moleculele de sare in curs de hidroliză, la cantitatea totală a moleculelor de sare în soluție.
Evident, gradul de hidroliză al h poate varia, în următoarele limite:
0 £ h £ 1 în acțiuni unitare
0 £ h £ 100%
constantă de hidroliză determină starea de echilibru chimic în soluția de sare de hidroliză.
De exemplu, pentru o stare de echilibru a etapei de hidroliză I și Na2CO3 ZnCl2 Kgidr exprimate prin ecuațiile:
.
În general, Kgidr variază între următoarele limite:
£ 0 £ Kgidr
.
Condiția de echilibru hidroliză este puternic influențată de diverși factori: în primul rând, concentrația de apă în soluție și temperatura sistemului.
După cum se vede din ecuația hidroliză totală
sare + apa <=> Acid + bază
și ecuația constantei de hidroliză
creșterea concentrației de apă (sau schimbarea concentrației de sare) în soluție, din cauza constanță Kgidr deplasează echilibrul de la stânga la dreapta. Prin urmare, soluțiile diluate de sare și complet hidrolizat rapid decât concentrat și crește gradul de hidroliză cu soluție de diluare.
Schimbările de temperatură, de asemenea, afectează foarte mult starea de echilibru hidrolitice, deoarece temperatura crește gradul de creștere de hidroliză, ca urmare a unei creșteri semnificative a produsului ionic al apei.
Glinka NL Chimie generală. - M. Chemistry, 1978. - P. 228-260.
Constantei dielectrice e * caracterizează polarizarea dielectrică de câmpul electric E.