Cauza curentului electric în celulă este diferența de potențial de electrod ale celor două sisteme redox. Această diferență este notată cu? E și numit forța electromotoare (EMF) a celulei. Deoarece EMF - o valoare pozitivă, se constată ca diferența dintre mare (catod) și un inferior (anod) valori Potențiale electrod:
Tabelul Potențialele redox standard,
Cel mai adesea într-o astfel de jumătate de reacție a recupera tabele nu sunt în ordinea crescătoare a valorilor E o. și grupate pe baza conținutului lor de anumite elemente, de exemplu, azot, mangan, crom, etc. Vă rugăm să rețineți următoarele. Tabelul în conformitate cu recomandările IUPAC, toate jumătate de reacție scrisă ca procesele de recuperare. deși în orice recuperare OVR jumătate de reacție este întotdeauna combinat cu o jumătate de reacție de oxidare. Amintiți-vă că recuperarea două jumătăți de reacții de la stânga la dreapta sunt întotdeauna o jumătate de reacție are loc cu o valoare mai mare de E o. Cealaltă jumătate a reacției cu o valoare mai mică de E este întotdeauna curge în sens invers, și este de fapt o jumătate de reacție de oxidare. Prin urmare, în prepararea ecuațiilor jumătate de reacție OVR cu o valoare mai mică de E nevoie să „transforme“ în oxidarea jumătate de reacție. În acest scop, în ecuația corespunzătoare, necesare pentru a schimba formele oxidate și reduse, lăsând electroni pe partea stângă, dar înainte de numărul de a schimba semnul „plus“ la „minus“. Rețineți că semnul potențialului de electrod nu se schimba!
Folosind valorile electrodului sau potențialele jumătate de reacție redox, este posibil să se efectueze următoarele operațiuni:
1. Proprietăți Rate redox ale substanțelor.
Din proprietăți mai multe mai multe substanțe silnymivosstanovitelnymi are substanță, care corespunde cu jumătate de reacție cu o valoare mai scăzută a potențialului. In schimb, mai multe proprietăți silnymiokislitelnymi are substanță, care corespunde cu jumătate de reacție cu valoarea potențială mai mare.
2. Prezice posibilitatea de bază de reacție în
Progresul reacției redox în această direcție este posibilă numai atunci când potențialul de jumătate de reacție care implică agentul de oxidare folosit este mai mare decât potențialul de reacție a jumătate implică agentul de reducere utilizat.
3. Se determină direcția reacției.
Orice OVR curge întotdeauna în direcția în care jumătate reacția este efectuată la o valoare mai mare potențial. Această direcție corespunde unei reacții EMF valoare pozitivă. Cu toate acestea, trebuie să ne amintim că, în această direcție, reacția este practic ireversibilă sub EMF mai mare sau egal cu 0,4V. Dacă diferența de potențial este mai mică de 0,4 V, IAD și reacția decurge în mod reversibil direcția determinată de condițiile de implementare a acestuia.
4. Selectați posibilitatea cea mai probabilă a mai multor reacții-TION.
Dintre toate posibile WRA cel mai probabil va fi răspunsul, ceea ce corespunde valorii maxime (EMF).
3. Procesele redox care implică curent electric. se topește Electroliza și soluții apoase de electroliți. Electroliza cu electrozi inerți și activi. diagramele de proces electrod. Prepararea substanțelor anorganice și purificarea lor folosind un curent electric. Surse chimice.
E
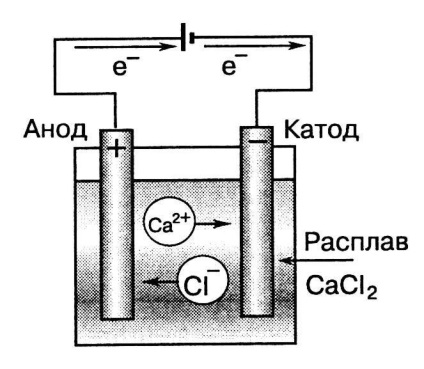
In electroliza, energia curentului electric este transformată în energie chimică, și în care procedeul este efectuat, invers se întâmplă în celulă.
Schema se topesc electroliza clorurii de calciu
Graficul Păstrarea publicului, notă care încarcă electrozii în timpul electrolizei electrod de sarcină opusă în celulă. Prin urmare:
Catod - încărcat negativ electrod, conectat la polul negativ al sursei de curent. Catodul în electroliza unui agent de reducere. Pe suprafața sa apar procesele de reducere a catodice. Catodul este întotdeauna realizat din materiale inerte (grafit, platină, aur, iridiu, etc.).
Anodul este electrod pozitiv care este încărcat de oxidant electroliza. Pe suprafața sa apar întotdeauna procesele de oxidare anodică. Anodul poate fi fabricat ca un material inert ( „inert“ sau „insolubil“ anod) și metalul capabil în timpul electrolizei trece în soluție ( „anod solubil“).
Prin trecerea unui curent electric prin soluția de electrolit sau topi ionii conținute în ea ia mișcare îndreptată: cationii încărcate pozitiv sunt trimise la catod încărcate negativ și negativ anioni încărcate - la catod încărcat pozitiv (figura 6.).
Procese la catod.
Electrolitul topit la catod este restaurat întotdeauna cationi metalici conform schemei: Men ++ = Me0 ne-.
În soluții apoase de electroliți asupra naturii proceselor catodice este determinat de natura cationilor:
g) cationi [Mn 2+ - Pb 2+]: cationii metalelor recuperate simultan și moleculele de apă.
Procese de pe un anod inert.