Esențială este problema mecanismului de disociere electrolitului-cal. Cel mai simplu mod de a disocia substanțe cu legături ionice. Este cunoscut faptul că aceste substanțe constau ioni. Dacă dipoli lor de apă de dizolvare sunt orientate în jurul ionii pozitivi și negativi. Între ionii și dipolii de apă, forțelor de atracție reciprocă. Ca rezultat, comunicarea dintre ionii este slăbită, există o tranziție a ionilor de cristal la soluție. Cu ...
Cu teorii de disociere electrolitice dau determina și descrie proprietățile acizi, baze și săruri. Acizii numit electroliți care se disociază pentru a forma cationi ca singurul hidrogen cationi H + H3PO4 + N2RO-4 (prima etapă) N2RO-4 H + + NRO2-4 (a doua etapă) NRO2-4 H + POZ-4 (a treia etapă) disocierea acidului polibazic se desfășoară în principal în prima etapă, într-o mai mică măsură, pe a doua și numai într-o mică măsură - pe a treia. De aceea, în soluție apoasă, pentru moleculele de acid exemplu phos-Forney H3PO4, împreună cu ioni disponibile (în cantități descrescătoare în mod succesiv) N2RO2-4 și NRO2-4 RO3-4. Baze denumite electroliti în timpul disociere sunt numai ionii de hidroxid formați ca anioni. De exemplu: KOH K + + OH-; ...
Deoarece disocierea electrolitica - un proces reversibil, acesta împreună cu ionii și moleculele prezente în soluțiile de electroliți lor. Prin urmare, soluțiile electrolitice sunt caracterizate printr-un grad de disociere (indicată prin litera alfa grecesc # 945;). Gradul de disociere - raportul dintre numărul de molecule sparte în ioni N „la numărul total de molecule de dizolvat N: Gradul de disociere a electrolitului este determinată empiric și exprimată ca o zecimală sau un procent. dacă # 945; = 0, disocierea este offline, și dacă # 945; = 1, sau 100%, electrolitul se dezintegrează complet în ioni. În cazul în care, cu toate acestea, # 945; = 20%, înseamnă că din 100 molecule de split electrolit 20 în ioni. Diverse electroliți au diferite grade de disociere. Experiența a arătat că depinde de concentrația electrolitului și temperatura. Odată cu scăderea concentrației de electrolit, ...
Conform teoriei disocierii electrolitice toate reacțiile în soluții apoase de electroliți sunt reacții între ionii. Ele sunt numite reacții ionice și ecuații ale acestor reacții - ecuații ionice. Ele sunt mai ușor de ecuații de reacție scrise în formă moleculară, și au un caracter mai general. La pregătirea Ecuațiile de ioni de reacție ar trebui să vatsya ghid care little- disociate materia, ușor solubile (precipitatele) și gazoasă înregistrate în formă moleculară. Stea ↓, stând în formula substanței indică faptul că substanța departe de reacție ca semn precipitat ↑ indică faptul că substanța este îndepărtată din reacție ca un gaz. electroliți puternici ca complet disociați, este înregistrată sub formă de ioni. Cantitatea de sarcini electrice de pe partea stângă a ecuației trebuie să fie egală cu valoarea de sarcini electrice dreapta. Pentru a consolida aceste prevederi, ia în considerare două exemple. Exemplul 1. Scrieți reacțiile dintre soluțiile de clorură ferică (III) și hidroxid de sodiu în formele moleculare și ionice. Vom împărți soluția în patru etape. 1 ....
KH2O = 1.10-4 Această constantă se numește produs ion apă de apă, care depinde numai de temperatura. Când disocierea apei în ioni H +, fiecare format OH- ioni, prin urmare, în concentrații de apă pură din aceiași ioni [H +] = [OH-]. Folosind valoarea produsului ionic al apei, descoperim: [H +] = [OH-] = mol / litru. O astfel de concentrație de ioni H + și OH- ...
Deasupra se arată că reacția este net neutră clorhidric-apă (pH = 7). Soluțiile apoase de acizi și baze sunt, respectiv, acid (pH <7) и щелочную (рН> 7) reacția. Practica arată însă că nu doar acizii și bazele, dar sărurile pot fi alcaline sau acide - motiv este hidroliza sărurilor. interacțiune săruri cu apă, rezultând acidul formarea (sau sare acidă) și baza (sau sare de bază), săruri numite hidroliză. Luați în considerare hidroliza sărurilor următoare tipuri principale: 1. Sărurile baze puternice și acid tare (de exemplu, KBr, NaNO3), atunci când este dizolvat în apă, nu hidrolizează și Ras creează sare are o reacție neutră ....
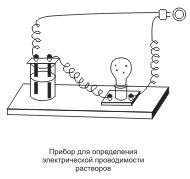
Este bine cunoscut faptul că anumite substanțe în soluție sau topitură-lennom capabil de a conduce curentul electric, în timp ce alții, în aceeași stare-condiți curentul nu se efectuează. Acest lucru poate fi văzut cu un dispozitiv simplu. Se compune din tije de carbon (electrozi) conectate la cablurile electrice ale rețelei XYZ. lampă electrică, ceea ce indică prezența sau absența curentului din circuitul inclus în circuit. În cazul în care electrozii mai mici în soluția Saha-ra, lampa nu se aprinde. Dar este puternic luminată, dacă este coborâtă în clorura de sodiu-stretch hoț. Substanțele care se disociază în ioni în soluții sau topituri și, prin urmare, electric conductoare, denumite electroliti. Substanțele care sunt în aceleași condiții pe ionii nu se rup și nu conduce curentul electric, numit non-electroliți. Pentru electroliții sunt acizi, baze și aproape toate sărurile la nonelectrolyte - cei mai mulți compuși organici, ...