Cantitatea de căldură
Zadanie81.
Se calculează cantitatea de căldură care este eliberată în timpul restaurării Fe 2 O 3, aluminiu metalic, în cazul în care se obține 335,1 g de fier. A: 2543.1 kJ.
soluţie:
Ecuația de reacție:
Valorile căldurilor standard de formare a substanțelor enumerate în tabelele speciale. Dat fiind faptul că căldura formării de substanțe simple, considerate în mod convențional ca fiind zero. Calculați căldura de reacție, folosind o consecință a Legii lui Hess, obținem:
= (2O 3) - (Fe2 O3) = -1669,8 - (- 822,1) = -847,7 kJ
Calcularea cantității de căldură care este eliberată în timpul pregătirii 335,1 g de fier, de proporții pro-chinuit:
unde 55.85 greutate atomică de fier.
Căldura de reacție
Sarcina 82.
Gazificat C2H5OH etanol poate fi obținut prin reacția etilenei C2 H4 (z) și vapori de apă. Scrieți ecuația termochimic pentru reacție, pre-calcularea efectului termic. Răspuns: -45.76 kJ.
soluţie:
Ecuația reacției are forma:
C2 H4 (g) + H2O (g) = C2H5 OH (g); =.
Valorile căldurilor standard de formare a substanțelor enumerate în tabelele speciale. Dat fiind faptul că căldura formării de substanțe simple, considerate în mod convențional ca fiind zero. Calculați căldura de reacție, folosind o consecință a Legii lui Hess, obținem:
= (C2 H5 OH) - [(C2 H4) + (H2O)] =
= -235.1 - [(52,28) + (-241.83)] = - 45,76 kJ
ecuații de reacție, care specifică stările lor de agregare sau modificării cristaline in jurul caractere compusi chimici precum valoarea numerică a efectelor termice se numește termochimic. Ecuațiile termochimice, dacă nu se menționează în mod specific, valorile indicate efectele termice la presiune constantă sistem Qp egal schimbare entalpie. Valoarea rezultat, de obicei, în partea dreaptă a ecuației, separându-l virgulă sau virgulă c. Următoarele abrevieri denotă starea de agregare a substanței: r - gazificat w - lichidul - cristalin. Aceste simboluri sunt omise, în cazul în care starea fizică a materiei este evidentă, de exemplu, O2. H2 și colab.
În cazul în care căldura eliberată în reacție, atunci <О. Учитывая сказанное, составляем термохимическое уравнение данной в примере реакции:
Sarcina 83.
Se calculează căldura de reacție de reducere a oxidului de fier (II), cu hidrogen, în conformitate cu următoarele ecuații termochimice:
soluţie:
reacția de reducere Ecuația de oxid de fier (II) cu hidrogen are forma:
OEOFM (k) + H2 (z) = Fe (k) + H2O (g); =?
Valorile căldurilor standard de formare a substanțelor enumerate în tabelele speciale. Dat fiind faptul că căldura formării de substanțe simple, considerate în mod convențional ca fiind zero. Căldura de reacție poate fi calculată cu ajutorul anchetei și anume legea Hess:
Căldura apei formării este determinată de ecuația
și căldura de formare a oxidului de fier (II) poate fi calculată prin ecuația (b) scade ecuația (a).
= (A) - (b) - (a) = -241,83 - [-283, o - (-13,18)] = +27,99 kJ.
Sarcina 84.
În reacția hidrogenului sulfurat gazos și bioxid de carbon format vapori de apă și disulfură de carbon CS2 (g). Scrieți ecuația termochimic pentru reacție, precalculați efectul său termic. Răspuns: 65,43 kJ.
soluţie:
ecuații de reacție, care specifică stările lor de agregare sau modificării cristaline in jurul caractere compusi chimici precum valoarea numerică a efectelor termice se numește termochimic. Ecuațiile termochimice, dacă nu se menționează în mod specific, valorile indicate efectele termice la presiune constantă sistem Qp egal schimbare entalpie. Valoarea rezultat, de obicei, în partea dreaptă a ecuației, separându-l virgulă sau virgulă c. Următoarele abrevieri denotă starea de agregare a substanței: r - gazificat w - lichidul - cristalin. Aceste simboluri sunt omise, în cazul în care starea fizică a materiei este evidentă, de exemplu, O2. H2 și colab.
Ecuația reacției are forma:
2H2 S (g) + CO2 (g) = 2H2O (g) + CS2 (z) =?
Valorile căldurilor standard de formare a substanțelor enumerate în tabelele speciale. Dat fiind faptul că căldura formării de substanțe simple, considerate în mod convențional ca fiind zero. Căldura de reacție poate fi calculată cu ajutorul anchetei și anume legea Hess:
= (H2O) + (CS2) - [(H2 S) + (CO2)];
= 2 (-241.83) + 115.28 - [2 (-20.15) + (-393.51)] = 65,43 kJ.
ecuația termochimică va fi:
2H2 S (g) + CO2 (g) = 2H2O (g) + CS2 (g); = 65,43 kJ.
Termohimicheskoe ecuația reacției
Sarcina 85.
Scrieți ecuația termochimic pentru reacția dintre CO (g) și hidrogen, care a avut ca rezultat formarea de CH4 (g) H2O (g). Cum căldura eliberată în timpul reacției, când s-a obținut metan 67,2 litri, în funcție de starea normală? Răspuns: 618.48 kJ.
soluţie:
ecuații de reacție, care specifică stările lor de agregare sau modificării cristaline in jurul caractere compusi chimici precum valoarea numerică a efectelor termice se numește termochimic. Ecuațiile termochimice, dacă nu se menționează în mod specific, valorile indicate efectele termice la presiune constantă sistem Qp egal schimbare entalpie. Valoarea rezultat, de obicei, în partea dreaptă a ecuației, separându-l virgulă sau virgulă c. Următoarele abrevieri se referă la starea de agregare a materiei, r - gazos, bine - ceva - cristalin. Aceste simboluri sunt omise, în cazul în care starea fizică a materiei este evidentă, de exemplu, O2. H2 și colab.
Ecuația reacției are forma:
CO (g) + 3H2 (g) = CH4 (g) + H2O (g); =?
Valorile căldurilor standard de formare a substanțelor enumerate în tabelele speciale. Dat fiind faptul că căldura formării de substanțe simple, considerate în mod convențional ca fiind zero. Căldura de reacție poate fi calculată cu ajutorul anchetei și anume legea Hess:
= (H2O) + (CH4) - (CO)];
= (-241.83) + (-74.84) - (-110.52) = -206.16 kJ.
ecuația termochimică va fi:
22,4: 67,2 = -206.16: x; x = 67.2 (-206.16) / 22 4 = -618.48 kJ ?; Q = 618,48 kJ.
căldura de formare
Sarcina 86.
Efectul termic al reacției este căldura de formare. Calculați căldura de formare a NO, pe baza următoarelor ecuații termochimice:
a) 4NH3 (g) + 5O2 (g) = 4NO (g) + 6N2 O (g); = -1,168.80 kJ;
b) 4NH3 (g) + 3O2 (g) = 2N2 (g) + 6N2 O (g); = -1,530.28 kJ
Răspuns: 90.37 kJ.
soluţie:
căldură standard de formare este egală cu căldura de reacție, formarea de 1 mol de substanță din substanțe simple, în condiții standard (T = 298 K, P = 1.0325 105 Pa.). Formarea de NO din substanțe simple pot fi reprezentate după cum urmează:
reacție dată (a), în care este dat format 4 moli de NO și reacția (b), care produce 2 moli de N2. In ambele reacții implicate oxigen. Prin urmare, pentru a determina căldura standard a formării de NO formează următorul ciclu Hess, adică trebuie să onoreze, ecuația (a) de la (b) ..:
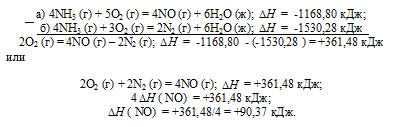
Astfel, 1 / 2N2 + 1 / 2O2 = NO; = 90.37 kJ.
Sarcina 87.
clorura de amoniu cristalină este format prin reacția amoniacului și acid clorhidric gazos. Scrieți ecuația termochimic pentru reacție, pre-calcularea efectului termic. Cât de mult de căldură este evidențiată, în cazul în care 10 l de amoniac a fost consumat în reacție, în funcție de starea normală? Răspuns: 78,97 kJ.
soluţie:
ecuații de reacție, care specifică stările lor de agregare sau modificării cristaline in jurul caractere compusi chimici precum valoarea numerică a efectelor termice se numește termochimic. Ecuațiile termochimice, dacă nu se menționează în mod specific, valorile indicate efectele termice la presiune constantă sistem Qp egal schimbare entalpie. Valoarea rezultat, de obicei, în partea dreaptă a ecuației, separându-l virgulă sau virgulă c. A adoptat următoarele lucruri pentru a - cristalin. Aceste simboluri sunt omise, în cazul în care starea fizică a materiei este evidentă, de exemplu, O2. H2 și colab.
Ecuația reacției are forma:
NH3 (g) + HCl (g) = NH4Cl (k). ; =.
Valorile căldurilor standard de formare a substanțelor enumerate în tabelele speciale. Dat fiind faptul că căldura formării de substanțe simple, considerate în mod convențional ca fiind zero. Căldura de reacție poate fi calculată cu ajutorul anchetei și anume legea Hess:
= (NH4Cl) - [(NH3) + (HCl)];
= -315.39 - [-46,19 + (-92,31) = -176,85 kJ.
ecuația termochimică va fi:
Căldura eliberată în timpul reacției, 10 litri de amoniac din reacție a fost determinată din pro-porțiuni:
- Sunteți aici:
- principal
- sarcini
- Chimie-Shimanovich
- Ecuația electronică a proceselor anodice și catodice | Sarcini 287-289