Informații generale privind valența de clor
Clorul este a treia etapă a principalelor subgrupul grupa VII (A) a tabelului periodic.
În condiții obișnuite clor - gaz de culoare galben-verde. Punct de topire - 101,0 ° C, punctul de fierbere -34,2 o C. organic solubil în apă. După răcirea soluțiilor apoase hidrati cristaline alocate sunt compoziții aproximative hlaratami Cl2 x 6H2 O și Cl2 x 8H2 O.
Clor - comburant activ.
Clor molecula diatomica Cl2.
compuși ai clorului valența
Clor - datorită elementului șaptesprezecelea al Tabelului Periodic D. Mendeleev. Acesta este situat în a treia perioadă în grupul VIIA. In nucleu, atomul de clor conține 17 protoni și neutroni 18 (număr de masă este de 35). Atomul de clor este de trei nivele de energie la care electronii sunt 17 (Fig. 1).
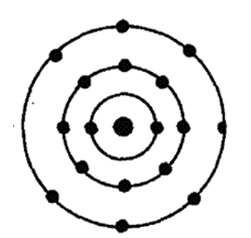
Fig. 1. Structuri atom de clor.
E formula de atomi de clor în starea fundamentală este următoarea:
Și diagrama energetică (construită doar pentru nivelul de energie de electroni exterior, care se numește în mod diferit de valență):
Prezența unui electron nepereche indică faptul că clorul este capabil de a expune o valență I (cea mai mică valență) în compușii săi (NaCl I. NaCl I O, CI I 2 O).
prezența mai multor stări excitate de faptul că orbitalii 3d -podurovnya rămase libere (în al treilea strat, în plus față de energie și 3S- 3p-subnivele este subnivel-3d, de asemenea) este caracteristic pentru un atom de clor. În primul rând aburit electroni 3p -podurovnya și ocupă orbitalii d libere, și după - 3s electroni -podurovnya:
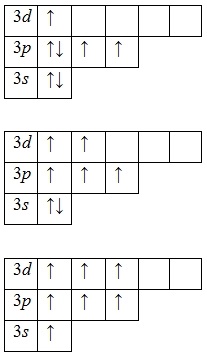
Având trei, cinci și șapte electroni nepereche în stare excitată indica faptul ca exponatele de clor în valența compușii III (NaCl III O2), V (KCl V O3) și VI (KCl VII O4. Cl VII 2 O7) (cea mai mare valenței ).
Formal clor poate fi valenței IV (ClO2) și VI (Cl2 O6).