Atom - este cel mai mic stabil (în majoritatea cazurilor) particulă de materie. Molecule de asemenea, numit mai mulți atomi legați împreună. Această moleculă este stocată în sine informația cu privire la toate proprietățile unei anumite substanțe.
Atomii formează molecula de tipuri diferite de comunicare. Acestea diferă în direcția și energia, cu care se poate stabili această relație.
Modelul cuantică a legăturii covalente
Legătura covalentă este formată prin electroni de valență. Când doi atomi există o suprapunere a norilor de electroni. Electronii fiecărui atom începe să se deplaseze într-o zonă care aparține un alt atom. În spațiul din jurul lor, există un potențial negativ, în exces, care trage nucleu încărcat pozitiv. Acest lucru este posibil numai cu condiția ca spinii totale de electroni sunt antiparalele (îndreptate în direcții diferite).
Legătura covalentă se caracterizează printr-o energie de legare destul de mare per atom (aproximativ 5 eV). Acest lucru înseamnă că este nevoie de 10 eV până la doi atomi ai moleculei, formată prin legături covalente rupt. Atomii pot veni mai aproape unul de altul la un stat strict definit. Cu această convergență de suprapunere a norilor de electroni observate. Principiul Pauli prevede că în jurul valorii de același atom nu se poate roti doi electroni în aceeași stare. Cu cât există o suprapunere, cu atât mai mult atomii se resping reciproc.
legătură de hidrogen
Acesta este un caz special al unei legături covalente. Este format din doi atomi de hidrogen. Acesta este un exemplu al acestui element chimic în douăzeci de ani ai secolului trecut, sa demonstrat mecanismul de formare a legăturii covalente. Atomul de hidrogen este foarte simplu, în structura sa, ceea ce a permis oamenilor de știință să rezolve exact ecuația Schrödinger.
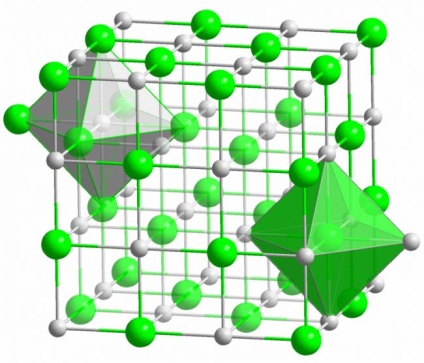
legătură ionică
Crystal toate sare cunoscute formate prin legături ionice. Apare cand atomii care formează molecula, au o mare diferență în electronegativitate. electronegativ mai puțin (în cazul cristalului de sare este de sodiu) trimite toate clor și electroni de valență, devenind un ion încărcat pozitiv. Clorul, la rândul său, devine un ion încărcat negativ. Acești ioni sunt legați în structura unei interacțiuni electrostatice, care se caracterizează printr-o forță destul de mare. De aceea, rezistența legăturii ionice are cea mai mare (10 eV per atom, care este de două ori mai mare decât energia unei legături covalente).
In cristale ionice defecte de diferite tipuri observate rar. interacțiune electrostatică ține ferm ionii pozitivi și negativi, în anumite locuri, dând să apară dal post vacant ofinterno- și alte defecte ale rețelei cristaline.