Legătura peptidică în natura lor chimică și este atașat covalent la rezistența ridicată a structurii primare a moleculei de proteină. Deoarece unitatea repetitivă a lanțului polipeptidic, și având caracteristicile specifice ale structurii, legătura peptidică afectează nu numai forma structurii primare, ci și pe un nivel mai ridicat de organizare a lanțului polipeptidic.
Pentru peptide (amidă) grupuri de structura caracteristică originală.
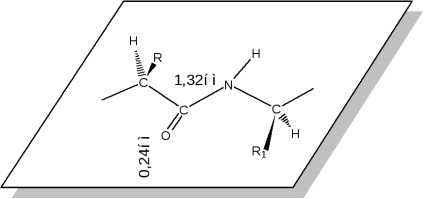
Toate cele patru atomi - N, C, OiCraspolagayutsya coplanar că otvechaetsp 2 hibridizarea atomi de carbon și oxigen al grupării carbonil. pereche de electroni unshared atomului de azot ia electroni pereche s ale dublei legături a grupării carbonil. Ca rezultat, peptidele C-NB și proteinele foarte mult scurtat, iar dublă legătură C = O este extinsă. Din punct de vedere al structurii electronice a grupului de peptide este un sistem p- conjugat cu trei centru, în care densitatea de electroni este deplasată spre un atom de oxigen mai electronegativ. Astfel, există electroni mare (atom = O) și proprietăți acceptor de electroni (atom de N la azotul), care crește brusc capacitatea acestor atomi la legătura de hidrogen, care se produce din cauza cea mai importantă proprietate a proteinelor - structuri de formă infinit diverse forme:
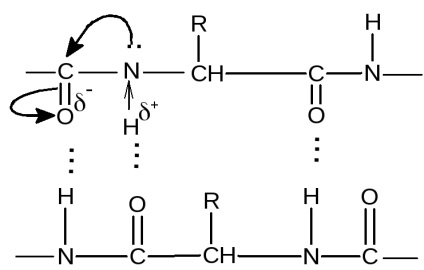
Fiecare grup de peptide pot forma două legături de hidrogen cu alte grupări, incluzând peptida. Excepțiile sunt grupuri de peptide formate cu participarea pralina aminoacizi sau hidroxiprolina, care sunt capabile să formeze o singură legătură de hidrogen. Lanțul peptidic la un situs unde sunt prolină sau hidroxiprolinei, ușor îndoit, din moment ce nu a păstrat ca, a doua legătură de hidrogen obișnuit.
Ca urmare a faptului că legătura peptidică poate exista sub forma ceto-enol (prezență plat sistem conjugat)
rotație în jurul-N-comunicarea C este interzisă și toți atomii incluși în grupul de peptide sunt configurație trans. Cis-configurație este energetic mai puțin favorabilă și a găsit doar în unele peptide ciclice.
Compoziția lanțului polipeptidic elementelor structurale rigide (grup de peptide plate) alternează cu porțiuni relativ mobile (-SNR) care sunt capabile să se rotească în jurul obligațiuni, deși o astfel de rotație poate fi destul de limitată din cauza dificultăților în distribuția spațială a lanțurilor laterale (R), resturi de aminoacizi. Astfel, structura electronică și sterică a grupelor peptidice afectează plierea lanțului polipeptidic în spațiu și, mai presus de toate, determină formarea structurii secundare a proteinelor.
structura secundară
Structura secundară a proteinelor este un proces pentru lanțurile polipeptidice într-o formă de stivuire ordonată datorită sistemului de legături de hidrogen, adică, determinarea orientării spațiale a lanțului polipeptidic. Două forme ale structurii secundare: elicoidale (-helix), care are loc într-o singură catenă polipeptidică, isloisto coli (-structură) - între catene polipeptidice adiacente.
Deși structura elicoidală în lanțurile polipeptidice ale proteinelor găsite în formă de porții individuale, se ataseaza la molecula de proteine putere suficient de ridicată, provoacă atât proximal și forțele procedurale distale implicate în stabilirea de legături de hidrogen.
-Helix ia în considerare toate proprietățile legăturii peptidice, configurația sa are o simetrie elicoidală. se transformă spiralei sunt regulate; toate resturile de aminoacizi din catena helix egal, indiferent de structura lanturilor laterale, acestea din urmă nu participă la formarea -helix. Intr-o spirală vitke este 3,6 resturi de aminoacizi. Spirala poate fi descrisă de secvența
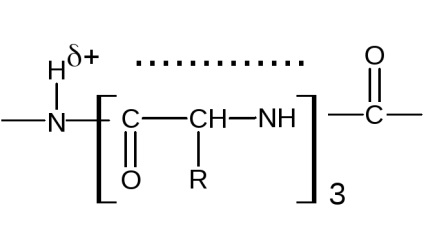
cu 13 atomi în inel (resturile de acid R-amino), unde D ... H - legături de hidrogen.
Fiecare grup de peptide formează o legătură de hidrogen cu un sfert din ea din cauza grupului de peptide.
-Helix oferă cele mai mici conexiuni de tensiune, dimensiunea minimă de spațiu liber în apropierea axei și dimensiunile minime ale bobinei Helix. -Helix a fost descoperit in hemoglobina cristalină, și mai târziu - în aproape toate proteinele globulare.
Layered structura pliată (-structură) are o configurație ușor curbată u-carbon atom al lanțului polipeptidic și este formată prin legăturile de hidrogen intercatenare.
Foi pliate pot fi formate în paralel cu lanțurile polipeptidice (N-capete sunt îndreptate în aceeași direcție) și antiparalele (N-capete sunt orientate în direcții diferite). structuri cutate au fost gasite in multe din proteinele structurale (colagen, cheratina, fibroină mătase).
Setate, -helixuri Structurile i este un criteriu important, prin care să judece gradul de structura de ordine al moleculei de proteină, stabilitatea proteinelor prin acțiunea mediilor factori fizici și chimici.
alte două niveluri au fost stabilite pe baza cercetărilor recente de proteine globulare: structura sverhvtorichnaya caracterizează unitățile preferate energetic ale idomeny structurii secundare - o parte a Globula proteinelor care sunt suficient regiune globulară izolată.
Structura Sverhvtorichnaya (supercoil) - este ansambluri care interactioneaza structuri secundare. Apariția acestor benzi indică faptul că acestea sunt preferabile din punct de vedere, fie cinetica de coagulare, sau câștigul de energie liberă în proteinele deja pliate. Superspiralizovannaya-helix se găsește în proteine fibroase.
În conformitate cu domenii înțeles în mod obișnuit suboblasti independent compact constând dintr-o proteină caracterizată printr-o suprafață minimă pentru raportul de volum, și prin aceea că numărul de legături funcționale în compoziția domeniu depășește în mod semnificativ faptul că, în comparație cu domeniile învecinate. De obicei, domenii efectua funcții specifice și domenii, prin urmare, nazyvayutfunktsionalnymi.