7. formează formula moleculară a substanței. Deoarece masa molară a substanței este de 2 ori mai mare masa molară a CH2O, indicii în formula trebuie crescută de 2 ori:
(CH2 O) · 2 = C 2 H 4 O 2.
A: formula moleculară substanță - C 2 H 4 O 2.
Întrebări și Sarcini
1. Porțiunile substanțe Având în vedere: a) cântărind 0,64 g de cupru; b) masa de apă, 3,6 g; a) Al 2 O 3 în greutate de 51 g; d) glucoză C 6 H 12 O 6 45 chimic greutate a fost calculată cantitatea fiecăreia dintre aceste substanțe, precum și numărul de atomi conținute în acesta.
2. 0,54 g greutate aluminiu reacționat complet cu masa de sulf de 0,96 g de produs de reacție Set formula și numele acestuia.
3. Compus de azot cu hidrogen, fracția masică de hidrogen este de 12,5%. Instalați formula moleculară a acestui compus, dacă are o densitate relativă a aerului este de 1,1.
4. calcinarea soda cristalină Na2 CO3 · x H 2 O masă 5,72 g material solid anhidru format o masă de 2,12 g Determina formula cristalină inițială.
5. Amestecul de gaz constă din volumul de oxigen (n. Y.) 4.48 dm 3 și oxidul de sulf (IV) volum (n. Y.) 6,72 dm 3. Se calculează masa acestui amestec și densitatea sa relativă în raport cu hidrogenul. Ce sumă (n. Y.) poate fi preparat prin reacția compușilor menționați de oxid de sulf (VI)?
6. descompunerea termică a unei substanțe cântărind 2,45 g a fost formată o greutate de 1,49 g de clorură de potasiu și a evoluat volumul de oxigen (n. Y.) 672 cm 3. Se determină formula substanței.
7. La arderea completă de materii organice s-au format cu o greutate de 13,8 g de oxid de carbon (IV), cântărind 26,4 g și 16,2 g de apă masa Localizati formula moleculară
substanțe, dacă densitatea relativă a vaporilor de hidrogen este de 23.

STRUCTURA ATOMICE ȘI DREPT PERIODIC
§ Structura 11. Atomice
Atom - cel mai mic increment de compuși simpli și complecși. Vorbind despre atomi, am subliniat că este chimic particule indivizibile nu dispar sau apar în timpul reacțiilor chimice.
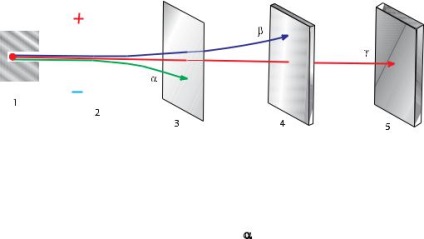
Timp de secole atom considerat unitate, adică. E. particulă Mai indivizibil. Și doar descoperirile făcute de fizicieni în secolul al XIX-lea, a dat dovezi puternice complexitatea structurii atomilor. Aceste descoperiri sunt în primul rând: a) studiul de electroliză. . Proces de descompunere a substanțelor Ie electrocutarii .; b) Deschiderea razelor catodice - fluxul de particule încărcate negativ, care ulterior sunt numite electroni; și în final c) detectarea radioactivității. care este dezintegrarea spontană a atomilor pentru a forma un element de atomi ai altor elemente.
Modelul nuclear al structurii atomice
La începutul secolului XX, bazat pe cercetarea de mulți oameni de știință și, mai presus de toate, pentru a dobândi numele nuclear al fizicianului englez Ernest Rutherford a fost stabilit modelul idealizat al structurii atomice (planetar). Conform acestui atom de model constă dintr-un nucleu încărcat pozitiv și se deplasează în jurul electronii încărcați negativ. Aproape întreaga masă a atomului (mai mult de 99,96%) este concentrată în nucleul său. Diametrul miezului de aproximativ 100, 000 de ori mai mică decât diametrul atomului (de ordinul 10 -8 cm).
Diametrul cel mai mare atom (France Fr) mai mare decât diametrul celui mai mic (atom heliu He) este mai mare de 7 ori, masa a (elementul atomic având un număr atomic 118) grele este mai mare decât masa celei mai ușoare (atom de hidrogen) este de aproape 300 de ori.
Compoziția nucleelor atomice
Conform ideilor moderne nucleele atomice sunt compuse din două tipuri de particule: protoni și neutroni. cu denumirea comună a nucleonilor (din nucleul latin -. nucleu).
Protonii și neutronii au substanțial aceeași masă de aproximativ 1u, t. E. O unitate de masă atomică (vezi. § 4). Proton (simbolul său p) are sarcina 1+, și neutroni (simbolul n) este electric neutru.
Acuzația de electroni (simbolic notație e -) este egal cu 1, iar greutatea este de 1836 de ori mai mică decât masa unui proton. Prin urmare, este clar că aproape toată masa unui atom este concentrată în nucleul său.
Tabelul 4 prezintă principalele caracteristici ale particulelor elementare care cuprind atomul.
Tabelul 4. Caracteristicile de bază ale particulelor elementare care cuprind atomul
Protonii și neutronii din nucleu sunt deținute puteri speciale, care sunt numite forțe nucleare. Forțele nucleare funcționează numai la distanțe foarte scurte (de ordinul a 10 -13 cm), dar valoarea lor în sute și mii de ori mai mare decât forța de respingere a protonilor încărcate, cum ar fi. Energia de legare a nucleonilor in nucleele atomilor dintr-un milion de ori energia unei legături chimice.
De aceea, atunci când reacțiile chimice nucleele atomice nu sunt distruse, ci doar rearanjarea atomilor are loc.
Numărul de protoni (Z) în nucleul unui atom se numește numărul de protoni. Este egal cu numărul atomic al elementului și de a determina locul său în sistemul periodic. Acesta este sensul fizic al numărului atomic. Numărul atomic determină locația elementului în sistemul periodic, și de aceea este adesea menționată ca un număr de serie.

Structura atomică și Drept periodică
Acuzația nucleului este determinat de numărul de protoni, și ca un întreg atom electro-
neutru, este evident că numărul de protoni din nucleu este egal cu numărul de electroni.
Numărul total (N) de protoni (Z) și neutroni se numește masa (sau
nucleon) numărul (A):
numărul de masă determină atom practic greutatea în unități atomice, deoarece masa de electroni este o parte neglijabilă din masa totală a atomului.
Acuzația nucleului atomic (număr de protoni) și numărul său de masă indică pur
Indicii lovymi stânga simbolul unui element chimic A X. Z De exemplu: 14 iulie a anului N,
52 24 Cr. 92 235 U.
Vezi atomi cu anumite valori ale numărului și masa numărul atomic se numește nuclid.
Se utilizează pentru a desemna nuclides nume de elemente sau simboluri care indică masa (nucleon) din: carbon-12, sau 12 C, oxigen-17, sau
17 O, 35-clor sau 35 Cl.
Cele mai multe elemente există în forma mai multor nuclizi care diferă unul de altul prin numărul lor în masă. Acest lucru se datorează faptului că, în nucleele lor cu același număr de protoni poate fi un număr diferit de neutroni. Astfel, un oxigen natural (Z = 18), cu excepția atomilor din nucleu care
16 8 neutroni este O, are nuclide cu numere de neutroni 9 și 10 - 17 și O
18 O. Astfel de nuclides sunt izotopi (din greaca Izosov -. Egal topos, - poziția), adică, „care ocupă un loc“ în Tabelul Periodic ...
Izotopi - nuclide cu același număr atomic, dar numere de masă diferite.
Cu alte cuvinte, izotopi - l nuclide de același element. Prin urmare, termenul de „izotop“ ar trebui să fie folosite numai la plural. Izotopii fiecare element ocupă de fapt, un loc în sistemul periodic,
greutatea atomică a elementului este numărul mediu de masă de nuclizi având în vedere proporția fiecărui în amestec natural. Aceasta explică faptul că masa atomică relativă a elementului majoritar
Polițiștii nu sunt valori întregi.
De exemplu, există carbon în natură ca două nuclides - 12 C (proporția naturală din amestec este egal cu 0.9889) și 13 C (proporția care este egală cu 0,0111). Masa atomica relativa a acestui element este:
A r (C) = 0.9889 · 12 + 0,0111 · 13 = 12.011.
Toate nuclizi sunt împărțite în două tipuri: stabile și radioactive (radio,
nuclide). izotop stabil poate exista fără schimbarea compoziției nucleului la infinit. Prin urmare, majoritatea nuclides naturale, care fac parte din substanțele stabile din jurul nostru.
Starea stabilă a nucleelor atomice corespund unor raporturi ale numerelor de protoni și neutroni: pentru elemente luminoase (numere atomice la 1 la 20) - Z / N ≈ 1 pentru grele - aproximativ 0,6. În caz de încălcare a raportului proton-neutron de miez (și cu ea și atomul) devine
Radioactivitatea numita transformare spontană de nuclee instabile în celălalt miez, însoțită de emisia de particule diferite.
În acest caz, de fapt, este electronii -particle produși în atomul de miez prin conversia unui proton într-un neutron:
1 0 1 1 n → p + e -.
Dezintegrarea radioactiva este adesea însoțită de o emisie de raze gamma - Hard flux cuante de radiații electromagnetice fără plată (a se vedea figura 7 ..).
Stabilitatea radionuclid se caracterizează printr-un timp de înjumătățire T 1/2 - timp în care numărul de nuclee scade din cauza cariilor la jumătate.
Pentru diferite radionuclizi, aceasta variază de la câteva fracțiuni de secundă la miliarde de ani. Astfel, pentru 28 Al înjumătățire plasmatică este de 2,2 minute, la 131 I - 8 zile, pentru 137 Cs - 30,17 ani, iar pentru 238 U - aproape 4.5 Gyr.
După descoperirea radioactivității a fost posibila transmutare artificială a unui element chimic în altul, sinteza nucleelor elementelor care nu există pe Pământ. Astfel sa obținut elementele aflate în sistemul periodic după uraniu U. Desigur, astfel de procese, cu toate că reacțiile nucleare numite, nu sunt reacții chimice în care atomii nu dispar sau reapar.

Statul unui electron dintr-un atom
Studiul de radioactivitate a condus la dezvoltarea energiei nucleare și, din păcate, a armelor nucleare. Fenomenul de radioactivitate este utilizat pe scară largă în știință, medicină, industrie și agricultură. Cu toate acestea, au existat probleme legate de efectele nocive ale radiațiilor asupra organismelor vii omenirii. Prin urmare, utilizarea proceselor nucleare și a substanțelor radioactive trebuie să fie efectuate în condiții strict controlate, în conformitate cu cele mai stricte măsuri de securitate.
Atom este electric microsistem neutră constând dintr-un nucleu încărcat pozitiv și electroni încărcați negativ.
Numărul atomic al elementului chimic este în raport cu sarcina nucleară a atomilor săi, numărul de protoni din nucleu și numărul de electroni din atom.
Vezi atomi cu anumite valori ale numărului și masa numărul atomic se numește nuclid.
Radioactivitatea - transformarea spontană a unor nuclee instabile în celălalt miez, însoțite de emisia de particule diferite.
Întrebări și Sarcini
1. Care sunt efectele fizice au fost dovezi de complexitatea structurii atomului? Dă o explicație pentru fiecare.
2. Definiți termenii „numărul de protoni“, „numărul de masă“.
3. cupru natural este un amestec de nuclizi 63 Cu și 65 Cu. proporţia
un amestec natural de egal cu 73%, al doilea - 27%. Calculați masa atomică relativă a cuprului.
4. Care este numărul de încărcare nucleară de neutroni și numărul de electroni din atom fiecare
din nuclid 35 CI, 40 K, 56 Fe, Pb 208?
5. Explicați motivul și natura radioactivitate. Ceea ce distinge izotopului radioactiv de la un izotop stabil al aceluiași element?
6. Se determină numărul de atomi de carbon în C 5 H 12 cantitate chimic de 0,2 mol.
§ 12. Statutul unui electron dintr-un atom
Proprietățile chimice ale atomilor sunt prezentate numai în reacții chimice. Deoarece compoziția nucleelor atomice nu este schimbat, este evident că modificările survenite cu atomul în transformarea chimică, sunt rezultatul modificării stării sale electronice.

Fig. 8. Diagrama norului de electroni unui atom de hidrogen
Structura atomică și Drept periodică
Cele mai multe dintre proprietățile atomului este determinată de structura sa electronică. Cum afectează proprietățile specifice ale atomului, proprietățile substanțelor, ca parte din care atomul este, poate fi înțeleasă doar în mod corect care reprezintă state
unui electron dintr-un atom.
Baza teoriei moderne a structurii atomice sunt legi și reglementări ale mecanicii cuantice val - ramura a fizicii, pentru a studia mișcarea de obiecte microscopice (electroni, protoni, neutroni și alte particule).
Conform ideilor cuantice-mecanice în mișcare natura duală de electroni inerente. Este o particulă (având o masă anumită, taxa), dar mișcarea sa în apropierea nucleului are un caracter de undă (nici o cale definit de mișcare, locația exactă în spațiu și altele.). În consecință, micro-obiecte, inclusiv de electroni, posedă simultan corpusculară și val proprietăți.
Din moment ce se deplasează de electroni în atom este absent traiectorie, pentru a descrie o astfel de abordare probabilistică mișcare este folosită. Matematic determinată nu poziția exactă a unui electron dintr-un atom, și probabilitatea prezenței sale într-un spațiu perinuclear zonă.
Stat (în mecanica cuantică este sinonim cu mișcarea) unui electron dintr-un atom este descris de -modul cuantică
Do - nor de electroni (Figura 8.). Electronul se deplasează în zona miezului la viteză mare, la care sarcina sa negativă, așa cum au fost „uns“ în spațiu. Se pare că miezul este înconjurat de un nor de electroni tri-dimensională. Densitatea norului de electroni este diferit în locații diferite. În acele locuri în care există adesea un electron obrazuet-
zonă de camping densitate de electroni mai mare.
Deoarece există o probabilitate de a găsi electronului, chiar și la o distanță relativ mare de nucleu, norul de electroni are anumite limite. Prin urmare, este de suprafață limită, de obicei, condiționată, care acoperă aproximativ 90% din norul de electroni. Această zonă se numește spațiul perinucleara de electroni orbital atomic sau pur și simplu orbital.

Fig. 9. conducere s orbitali -electron
Fig. Schema 10. p orbitali -electron
Statul unui electron dintr-un atom
Orbital - regiunea perinucleara a spațiului în care pentru a găsi cel mai probabil al electronului.
Orbitali, în funcție de energia de electroni, au diferite forme și mărimi. Astfel, un singur electron orbital al atomului de hidrogen are o formă sferică (ca o minge). astfel de
orbitali au o formă sferică, notate cu litera S. și electronii care ocupă aceste orbitali se numesc electroni S-
Cu cât energia unui electron dintr-un atom, cu atât mai puțin el este atras de miez, cu atât mai mare dimensiunea orbital (nor de electroni) său. Densitatea de electroni, cu o creștere a dimensiunii orbitalii
Orbitali în multielectron atomi și pot avea și alte forme, cum ar fi o formă halteră ( „vrac Opt“) (Fig. 10). Aceste orbitali sunt notate cu litera p. și electronii la care corespund, P- numite electroni.
Cele trei orbitali p sunt aranjate (orientate) în spațiul perinucleara de-a lungul reciproc perpendiculare una dintre cele trei axe ale sistemului de coordonate (fig. 11).
O formă mai complexă sunt orbitali d-tip și f tip.
Fig. 11. relative poziția p orbitalii într-un atom multielectron
Structura atomică și Drept periodică
Grăitor descris ca celulele orbitale (celule cuantice) și electron - sub formă de săgeți. Astfel, orbital atomului de hidrogen cu un singur electron poate fi reprezentată după cum urmează:
Deplasarea în continuare în jurul miezului, fiecare caracterizat printr-un moment al mișcării de electroni, care se numește de spin. de spin simplificată (de la centrifugare engleză -. Rotație) poate fi reprezentat ca o rotație de electroni în jurul propriei sale axe. Spinul unui electron poate fi rotit doar în sensul acelor de ceasornic sau invers acelor de ceasornic. Într-un orbital nu poate fi mai
doi electroni având opus spate (antiparalel).
În acest caz, doi electroni se numesc pereche:
O astfel de stare a unui atom este energetic favorabil. Spre deosebire de aceeași stare de spin:
În cazul în care un orbitali de electroni este, este nepereche.
Electronii dintr-un atom diferă în energia lor. Cu cât energia unui electron din atom, cu atât mai departe este din nucleu, prin urmare, cu atât mai mare dimensiunea norului de electroni (orbital). Pe de altă parte, electronii cu energie relativ scăzută sunt cele mai multe ori în apropierea nucleului, de protectie (screening-ul) de la alți electroni, care sunt atrase de nucleu sunt mai slabe și mai departe de ea. Astfel, format ca un înveliș de electroni aproape de valorile energiei. Se poate spune că electronii apropiate de valorile energetice constituie un singur electron în atom,
strat Throne. sau nivelul de energie.
Nivelul de energie (stratul de electroni, învelișul de electroni) Cu - un set de electroni cu energii lângă valori.
Numărul de nivele de energie într-un atom la care sunt electroni este egal cu numărul perioadei, care este un element chimic
ment în sistemul periodic. Fiecare nivel de energie este indicat prin numerele lor: n = 1, 2, 3, 4. ∞. Cu cât numărul de nivel, cu atât mai mare