la lista de prelegeri
la lista de articole
Acid sulfuric.
Printre acizii minerali, produse de industria chimică, acid sulfuric în ceea ce privește producția și consumul clasat pe primul loc. Acest lucru se explică prin două motive: prețul scăzut în comparație cu toate celelalte acizi, și proprietățile sale. Acidul sulfuric nu fume în formă concentrată nu distruge metalele feroase, în timp ce în același timp, este unul dintre acizi puternici, o gamă largă de temperaturi
(- ... 40-20 260 - 336,5 ° C) este în stare lichidă.
acid sulfuric anhidru (monohidrat) este un lichid uleios greu, care este amestecat cu apă pentru a elibera cantități mari de căldură. Densitate H2 SO4 la 0 ° C este egală cu 1,85 g / cm3 și o temperatură de cristalizare de 10,7 ° C
Cei mai mari consumatori de acid sulfuric este producerea de îngrășăminte: superfosfatul, sulfat de amoniu.
Mulți (acid fosforic, acid acetic, acid clorhidric, azotic concentrat și colab.) Și sărurile acestora produse într-o mare parte, cu ajutorul acidului sulfuric.
Acidul sulfuric este utilizat pe scară largă în producția de metale neferoase și rare, precum și în industria metalurgică. Prepararea unei serii de coloranți (pentru țesături), lacuri și vopsele (pentru clădiri și mașini) substanțe medicamentoase și anumite materiale plastice, de asemenea, se referă la utilizarea de acid sulfuric. Cu sulfuric produc etilic al acidului și alți alcooli, unii esteri, un surfactant, un număr de pesticide pentru combaterea dăunătorilor agricoli și buruieni.
Soluțiile diluate de acid sulfuric și sărurile sale sunt folosite în industria textilă și în alte industrii în industria ușoară. În industria alimentară, acidul sulfuric este utilizat pentru producerea de amidon, melasa și alte produse. În inginerie electrică, este folosit ca un electrolit din baterie. Acidul sulfuric este utilizat pentru uscarea gazului și la o concentrație de acizi. In final, acidul sulfuric a fost utilizat drept component mediu de reacție în procesul de nitrare, în special în prepararea explozivilor.
Când nitrarea în producția de etanol din etilenă, la o concentrație de acid azotic și alte procedee utilizate concentrația acidului sulfuric de la 92 la 98%, și eliminate din procesul diluat 50 - Acid secvență de 80%. soluție apoasă obținută a fost evaporată pentru a se recupera într-un nou ciclu.
producția sulfuric acid de bază brută - compuși care conțin sulf din care pot fi obținute în dioxid de sulf. In industrie, acid sulfuric 80% obținut de la un fier natural și sulf (sulf) pirită. loc important în balanța de mărfuri ocupă gazele de eșapament ale metalurgiei neferoase. Unele producție este utilizat ca hidrogen sulfurat prime formate la curățarea sulfului în rafinarea petrolului. Mai întâi prăjire materie primă conținând sulf pentru producerea dioxidului de sulf.
producția de acid sulfuric implică următoarea secvență de etape:
pirită calcinarea sau sulf.
Oxidarea dioxidului de sulf.
Absorbția trioxid de sulf.
minerale - - Materiile prime conține impurități, prin urmare, îndepărtarea de la gazele etapa de calcinare sunt curățate. Prima etapă - prăjire, specifice pentru fiecare tip de materie primă, și în continuare va fi luat în considerare pentru pirite și sulf ca materiile prime cele mai comune. oxidare și etapa de absorbție este în mod esențial aceeași în diferite moduri de a produce acid sulfuric. Prin urmare, acești pași vor fi considerate ca procedee tipice.
Prăjirea materiilor prime care conțin sulf.
pirite calcinarea (pirita) este un proces fizico-chimic complex și cuprinde un număr de serie sau reacții paralele apar:
Cu un ușor exces sau deficit de oxigen produs oxid de fier amestecat
Justificarea rolului parametrilor și alegerea lor.
Temperatura. Descompunerea termică a piritei începe la temperaturi de circa 200 ° C și sulf aprins simultan. La temperaturi de peste 680 ° C au loc intensiv toate cele trei reacții.
In industrie, coacerea a fost efectuată la 850 - 900 ° C, în cazul în care viteza totală de proces este limitată de transferul de masă al agentului de oxidare (oxigen) la suprafața pirită și produșii de degradare în faza gazoasă. În general, forța motrice pentru acest proces poate fi exprimat prin ecuația
Presiune. În conformitate cu ecuația (1), presiunea este un factor în viteză de reacție, dar poate avea ca rezultat, în modul condiții de creștere autotermică la o creștere excesivă a temperaturii, și aderența particulelor de material solid. Mai mult, presiunea crescută duce la comprimarea sporită a costurilor. Deoarece condițiile de ardere a temperaturii de reacție specificată pornește lin, este de preferat să se opereze la presiune atmosferică.
raport aer pirită este menținut la un nivel care asigură un exces de oxigen, în comparație cu valoarea sa stoichiometric pentru a atinge un grad înalt de prăjire, însă acest exces nu trebuie să fie excesivă, deoarece la creșterea în exces considerabil de recuperare a sulfului din pirita de prăjire suprapuse gaz de diluare semnificativă și scăderea concentrației de SO2 în ele, ceea ce afectează în mod negativ procesul ulterior de oxidare a SO2 la SO3.
Anterior reactor tip dominant era reactor multicarrier echipat cu raclete pentru strat de aliniere pe fiecare transport de organizare raft și solide din partea superioară spre rafturile inferioare (cm. Tipuri de reactoare pentru reacții eterogene care implică o fază solidă).
Într-un astfel de reactor, gradul de pirite dispersie mici, care limitează în mod semnificativ capacitatea reactorului. Mai mult, în astfel de reactor raclete se deplasează în zona de temperatură ridicată complica designul său, creează o stare non-uniformă a temperaturii pe rafturi, este dificil de a asigura îndepărtarea căldurii din zona de reacție. constrângerile de îndepărtare a căldurii nu permit să se obțină calcinate concentrației de SO2 gazos de mai mult de 8 - 9%. Limitarea majoră - imposibilitatea utilizării particulelor fine, în timp ce pentru un proces eterogen al procesului principal pentru accelerarea reacției - fragmentarea particulelor. Din acest motiv, este vehicule mai promițătoare la „pat fluidizat“ solide. gradul lor de dispersie permite un ordin de a accelera procesul.
Sulful - substanță fuzibil: temperatura de topire 113 ° C înainte de a fi topite prin ardere cu ajutorul aburului obținut prin recuperarea căldurii de ardere sale. Sulful topit se sedimentează și se filtrează pentru îndepărtarea sulfului prezent în impuritățile naturale și pompat în cuptorul de ardere. Sulful arde în primul rând în starea în fază de vapori. Pentru a asigura evaporarea rapidă a acestuia, este necesar să-l dispersa în fluxul de aer. În acest scop, tip duză și cuptor cu ciclon. Primele duze de aer orizontale pentru atomizarea lichidului. Cuptorul ciclon, sulful lichid și aerul este alimentat tangential în detrimentul mișcării vortex de lichid se realizează și dispersia amestecarea celor două fluxuri. picături mici se evaporă rapid și sulf se arde în stare de vapori. Arderea are loc adiabatic și temperatura depinde de concentrația de CO 2 format.
Datorită căldurii ridicate de ardere a sulfului în temperatura cuptorului depășește 1000 ° C. Aceste condiții sunt suficiente pentru a vaporiza sulfului lichid. sobă funcționează împreună cu echipament accesoriu pentru topirea și filtrarea cazanul de recuperare a sulfului pentru utilizarea căldurii de reacție.
Gazele de prăjire pirită conțin impurități sub formă de compuși ai fosforului, seleniu, telur, arsenic, iar altele, sunt formate din impuritățile de materii prime. de umiditate a materiei prime naturale intră, de asemenea, în gazul. În arderea unui anumit număr de SO3 și posibili oxizi de azot. Aceste impurități duc la coroziune sau un aparat sau otrăvire a catalizatorului și deteriorează calitatea acidului sulfuric. Ele sunt îndepărtate în compartimentul de spălare. Conform Schemei secvențial de gaz trece prin două turnuri de spălare, soluții de acid sulfuric irigat (60 și 20% th). Primul turn, gazul se răcește calcinat 300-500 ° C la 60 - 70 ° C și se eliberează de impurități de praf și o parte reziduală. Acest turn este gol la interior. gaz desprăfuite spãlatã 15 - 20% acid sulfuric de compuși cu turn Ca, Fe, Se doilea pachet. uscare finală se realizează la o umiditate de 3 - 9 turnuri (uscare), irigate cu acid sulfuric concentrat.
Oxidarea dioxidului de sulf.
Este reversibilă și exotermă și continuă cu o scădere a volumului. Se realizează pe catalizatori care se bazează pe V 2 O 5, cu adaos de oxizi de metale alcaline sprijinite pe silice.
Justificarea rolului parametrilor și alegerea lor.
Temperatura este menținută caracteristică maximă a performanței reacțiilor exoterme reversibile. Trebuie apreciat faptul că creșterea excesivă a temperaturii poate duce la inhibarea procesului de difuzie, iar acest lucru poate afecta performanța și poziția valorii sale extremum.
Domeniul de temperatură este în mare măsură determinată de limita superioară și inferioară a acestui parametru. la T<400 0 C активность катализаторов весьма мала, а выше 600 0 С происходит их термическая дезактивация. Оптимальными являются температуры, лежащие внутри этих пределов.
Presiunea este un factor în viteză de reacție și factorul de schimbare de echilibru, cu toate acestea, în practică, din motive de economisire a energiei, și datorită posibilității de a obține un grad înalt de conversie și produc prin utilizarea altor factori preferat să opereze la presiuni apropiate atmosferice. Unele suprapresiune necesară pentru a depăși rezistența hidraulică la instalarea reactivilor de gestionare a traficului.
SootnoshenieO 2: SO 2. este factorul de schimbare de echilibru și factorul ratei de reacție în conformitate cu ecuația Boreskov
Cu toate acestea, acest raport este limitat la viteza maximă a încetinirii creșterii ridicată și o reducere semnificativă a SO2 în gazul de contact care curge pe absorbția, ceea ce reduce eficiența acesteia. În practică, un exces de O2 în mai mult de jumătate din stoichiometrice.
Timpul de contact este selectat pe baza conversiei maxime realizabile. Limita de astfel de conversie este gradul maxim de conversie la care viteza de proces este aproape de zero. Prin urmare, timpul de reacție este aleasă pentru timpul minim în care gradul de conversie este aproape aproape de echilibru. De obicei, această valoare este egală cu 90-95%, iar timpul său corespunzător - câteva secunde.
Tehnologia de contact okisleniyaSO 2.
Cel mai des folosite în aparatele rafturi industriale cu îndepărtarea căldurii de reacție între rafturi. Schimbător Schema implică utilizarea maximă a căldurii de reacție pentru preîncălzirea gazului de alimentare. În această îndepărtare a căldurii se realizează între flanșe în măsura în care permite temperatura de funcționare aproximativă la valoarea optimă a acestui parametru.
Una dintre cele mai importante sarcini ale producției de acid sulfuric este de a crește gradul de conversie a dioxidului de sulf și de a reduce emisiile sale. Această problemă de mai multe metode pot fi rezolvate.
Una dintre cele mai eficiente metode pentru a rezolva această problemă - metoda de contact dublu și dublu de absorbție (DKDA). Esența ei constă în faptul că amestecul de reacție în care conversia SO2 este 90-95%, se răcește și se alimentează un absorbant intermediar pentru a izola SO3; rămânând în raportul O reacție de gaz 2. SO 2 a crescut în mod semnificativ, ceea ce conduce la o schimbare a reacției de echilibru la dreapta. Din nou, gazul de reacție a fost încălzit din nou alimentat în aparatul de contact, în cazul în care se atinge 95%, conversia SO2 rămase. Gradul total de conversie ajunge la 99,5 SO 2 într-un astfel de proces - 99,8%.
Absorbția trioxid de sulf.
Absorbția trioxid de sulf - ultima etapă a procesului în care se formează acid sulfuric. Interacțiunea SO 3 cu apă
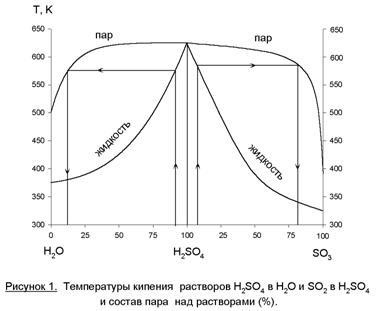
Equilibrium „gaz-fluid“ la «H 2 O - H 2 SO 4 - SO 3" prezentat în figura 1. O caracteristică a acestui sistem este acela că o gamă largă de concentrații de acid sulfuric prezent în vaporii de apă pură în fază de vapori, și peste oleum - în faza gazoasă domină SO 3. aceeaşi compoziție a fazelor lichide și vapori (punctul azeotropic) este la o concentrație de acid sulfuric 98,3%. Dacă absorb SO3 soluție cu o concentrație mai mică, reacția (3) se va proceda în faza de vapori - va forma ceață de acid sulfuric, care părăsește absorberul cu faza gazoasă. Acest lucru - și pierderea produsului și coroziunea aparatelor și a emisiilor. Dacă SO 3 absorbție oleum, absorbția este incompletă.
Aceste două proprietăți trebuie să fie o diagramă de absorbție în două etape (Figura 2). Gazul care conține SO3 după reactorul trece succesiv oleum (1) și monohidrat (2) absorbanți. O altă componentă a reacției (H2 O) alimentată în contracurent prin absorbantul de colectare monohidrat. Din cauza circulației intense a lichidului (absorbat) acesta poate fi menținut aproape de concentrația optimă de H 2 SO 4 - 98,3% (o creștere a concentrației a trecerii fluidului nu este circa 1 - 1,5%). absorbțiilor de concentrare asigură absorbția completă a SO3 și formarea minimă de ceață de acid sulfuric. monohidrat de acid din absorber este furnizat în Oleum. Circulă soluție 20% H2 SO4. care este prezentat parțial ca produsul final - oleum. Acidul din anterior absorber - monohidrat - poate fi, de asemenea, un produs. Sistemul de circulație asigură îndepărtarea căldurii de reacție și frigidere asigurând o absorbție mai eficientă. La temperaturi sub 100 ° C, SO3 este absorbit aproape complet, dioxidul de sulf - practic nu este absorbit.
Perspectivele de dezvoltare a producției de acid sulfuric.
Un mijloc puternic de creștere a productivității este de a crește producția de concentrația acidului sulfuric a dioxidului de sulf. Highly gazele care conțin până la 80% SO2 început deja să primească un metale neferoase din minereuri sulfuroase folosind oxigen tehnic.
Prepararea mare concentrație de gaz bioxid de sulf pentru a crea o producție energotechnological ciclică de acid sulfuric de sulf și pirită. Dioxidul de sulf este produs folosind oxigen industrial este oxidat cu 90% într-un aparat de contact cu un „strat plin“ catalizator. După absorbția SO3 obținut oleum foarte concentrat și monohidrat. Gazul după absorbția este recirculat contactării. În reactor, gradul global de conversie de 99,995%. Pentru drenarea acumulate prin porțiunea de recirculare cu azot repetată a gazului după absorbția de mici dimensiuni este trecut printr-o instalație de acid sulfuric, la care azotul este evacuat în atmosferă. Intensitatea sistemului ciclic, care funcționează sub o presiune de aproximativ 1 MPa cu oxigen de zece ori mai mare decât intensitatea sistemelor convenționale. Pierderile de sulf din gazele de ardere, SO2 și SO3, respectiv și a emisiilor în mediu este de asemenea redus de zece ori.
Schemele includ abur generatoare (4 MPa) prin căldura gazelor de ardere care pot fi utilizate atât în instalație, pentru a compensa consumul de energie pentru compresoarele și pompele, precum și în alte magazine ale instalației. Căldură gazele sulfuroase după trecerea următorului patul de catalizator poate fi utilizat pentru preîncălzirea reactanților la intrarea aparatului de contact. adsorbția de căldură pentru uz casnic.
Cele mai importante zone de producție de acid sulfuric sunt:
1. Creșterea echipamentul de alimentare în timp ce automatizarea simultan complexe de producție.
2. Procesul de intensificare prin aplicarea reactoarelor „pat fluidizat“ (ca în etapa de ardere, iar când oxidarea SO2 de contact), catalizatori mai activi, presiunile ridicate și utilizarea oxigenului tehnic în procesul de oxidare.
3. scheme de dezvoltare ehnergotehnologicheskih cu utilizarea maximă a căldurii a reacțiilor exoterme, inclusiv sisteme ciclice de presiune.
4. Creșterea grade de conversie în toate etapele pentru a reduce consumul de raporturi de materii prime și materiale și reducerea emisiilor nocive.
5. Eliminarea emisiilor periculoase din gazele de eșapament precum și deșeurile solide (calcinat). De exemplu, impurități nedorite, H2S și SO2 din diferite fluxuri pot fi combinate și supuse la concentrare, pentru a le transforma în sulf elementar.
Solidul lumânare care conține oxid de fier poate fi folosit ca un sorbent pentru captarea gazelor și a apei uzate.
la lista de articole
la lista de prelegeri