StirolC8H8 (feniletilen, vinilbenzen, etilbenzen) - lichid incolor, cu miros caracteristic. Practic insolubil în apă, solubilă în solvenți organici, un bun polimeri solvent.
Cele mai multe dintre stiren (aproximativ 85%) este preparată în degidrirovaniemetilbenzola industrie, la o temperatură de 600-650 ° C, presiunea atmosferică și se diluează cu abur supraîncălzit într-o perioadă de 3 - 10 ori. catalizatori oxid de fier crom folosite cu adaos de carbonat de potasiu.
Un alt proces industrial care primesc restul de 15% este degidratatsiimetilfenilkarbinola. formate în timpul preparării oxidului de propilenă din hidroperoxid etilbenzen. Etilbenzen hidroperoxid obținut prin oxidarea etilbenzenului necatalizată aerului.
Dezvoltat procedee alternative pentru prepararea stirenului. cyclodimerization catalitică a butadienei la vinil ciclohexena, urmată de dehidrogenare cu ea. cuplarea oxidativă toluenul pentru a forma stilben; metateza stilben cu etilenă conduce la stiren. Reacționând toluen cu metanol poate fi, de asemenea stiren preparat. In plus, a dezvoltat în mod activ metode pentru izolarea stirenului din produse lichide de piroliză. Până în prezent, nici unul dintre aceste procese nu este viabilă din punct de vedere economic și nu este pusă în aplicare pe scară industrială.
Stiren este usor oxidat, se adaugă halogeni. polimerizat (pentru a forma o masă solidă sticloasă - polistiren) și copolimerizate cu diverși monomeri. Polimerizarea are loc la temperatura mediului ambiant (uneori cu explozie), astfel încât în timpul depozitării stirenul stabilizat cu antioxidanți (de exemplu, tretbutilpirokatehinom. Hidrochinona). Halogenare, de exemplu prin reacția cu brom, în contrast cu anilină nu vorbim pe inelul benzenic, și gruparea vinii, pentru a forma 1,2 dibrometilfenil.
Stirenul este folosit aproape exclusiv pentru producerea de polimeri. Numeroase tipuri de polimeri pe bază de stiren includ polistiren. poliesteri stirenică, ABS (acrilonitril-butadien-stiren) și SAN (stiren-acrilonitril). De asemenea, incluse în napalmul stiren.
Propilen (propenă) CH2 = CH-CH3 -nepredelny (nesaturat) uglevodorodryada etilena, gaz combustibil. De droguri cu efect narcotic mai puternic decât uetilena. Clasa de pericol - a patra. [1].
Propilen este o substanță gazoasă, cu punct de fierbere scăzut p.f. = -47,7 ° C și un punct de topire punct topire = -187,6 ° C, densitatea optică a 4 d20 = 0.5193.
chimice
Are reactivitate semnificativă. Proprietățile sale chimice sunt determinate prin legătură dublă carbon-carbon. p-bond ca cel mai durabil și mai accesibile, în timp ce acțiunea reactivului este rupt și eliberați atomii de carbon de valență sunt cheltuite pe care unește atomii care formează molecula de reactant. Toate reacția de cuplare trece la dubla legătură și constă în divizarea comunicare π alchene și educație la ruperea la sol a două noi legături sigma.
Cele mai frecvente reacții se alătură pentru tipul heterolitice, fiind plus electrofil.
halogen Aderare (halogenare)
Reacția de halogenare este de obicei efectuată într-un solvent, la temperatura obișnuită. Halogenii se alăture cu ușurință în loc ruperea dublei legături pentru a forma digalogenoproizvodnyh. Este mai ușor atașarea de clor și brom, mai dificil - iod. Fluorul reacționează exploziv.
adăugarea de hidrogen (reacție de hidrogenare)
Prin adăugarea de hidrogen în prezența catalizatorilor (Pt, Pd, Ni), propena devine hidrocarbură saturată - propan.
Racordarea la apă (reacție de hidratare)
Propilen reacționează cu apa pentru a forma un izopropanol monoalcool, în care este dezvăluită dubla legătură.
halogenuri de aderare (Hhal)
Se produce regula Markovnikov. Hidrogenul Acid Hhal este atașat la atomul de carbon cel mai hidrogenat la dubla legătură. Prin urmare rest Hal se leagă la atomul de carbon la care numărul minim de atomi de hidrogen.
EXEMPLUL gidrogalogenirovaniya - obținerea propanul brom în reacția propilenei bromovodorodai.
] Aerului de ardere
Deoarece oxigenul din aer, forme de propilenă cu gaz amestecuri explozive.
În propilenă mediu apos neutru sau slab alcalin este oxidat cu permanganat de potasiu, care este însoțită de decolorarea și formarea de glicoli de soluție KMnO4 (compuși cu două grupe hidroxil la atomi de carbon adiacenți). Această reacție se numește reacția lui Wagner.
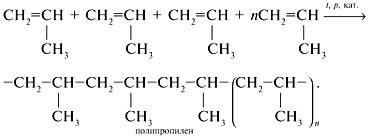
Condiții de reacție: căldură, prezența catalizatorilor. Molecula compus are loc prin scindarea intramoleculare π-Comunicare și formarea de noi intermoleculare sigma obligațiuni,.
Oxidarea cu oxigenul din aer la oxid de propilenă
Atunci când este încălzit în prezența catalizatorilor de argint:
1. Scindarea hidracid din halogenuri de alchil sub acțiunea unei soluții alcaline alcoolic:
2. Hidrogenarea propină în prezența catalizatorului (Pd):
3. Deshidratarea izopropanolului (eliminarea apei). Acidul catalizator (sulfuric sau fosforic) sau Al2 O3:
4. Clivaj doi atomi de halogen digalogenoalkanov cu conținut de halogeni pe atomi adiacenți C. Reacția sub acțiunea metalelor (Zn, etc.):