Substanța poate fi într-un volum la o temperatură T și presiune P. Aceste trei valori caracterizează starea stare materială numite parametri.
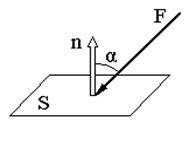
Presiunea P - este o valoare scalară ce caracterizează distribuția forțelor pe întreaga suprafață pe care operează, și este numeric egală cu forța care acționează de-a lungul zonei unității normale. (Figura 6.4)
unde # 945; - unghiul dintre direcția forței și normală la zona S.
Presiunea din sistemul SI se măsoară în pascali (Pa); 1 Pa = 1 H / m 2.
Unitate non-SI de presiune:
atmosferă fizică 1 kgf / cm2 = 9,8 x 10 4 N / m 2 = 0,98 x 10 5 N / m 2,
atmosferă tehnică 1.013 x 10 5 N / m 2. 1 mm Hg. Art. = 133 N / m 2,
1 bar = 10 5 N / m 2.
Temperatura măsurată pe scara Celsius, pentru care a adoptat zero și temperatura gheții care se topește Kelvin - temperatura la care viteza moleculelor # 965 = 0 (figura 6.5).
Temperatura în grade Celsius (° C) și Kelvin (ºK) conectat ºK relația T = t + 273 ° C.
6.4 viteză și energie Moleculele [distribuție Maxwell]
Pentru ușurința considerație mișcării moleculare. Să presupunem:
a) coliziuni de molecule de gaz apar ca ciocnirea elastică de bile;
b) o dimensiuni moleculare sunt mici în comparație cu neglijabil volumul ocupat de gaz;
c) între moleculele nu prezintă forțele de atracție reciprocă.
Gaze în care aceste condiții sunt numite ideale. Real apropierea acestui sistem simplu sunt gaze la presiuni scăzute și temperaturi foarte ridicate. Acesta poate fi considerat un aer ideală, azot, oxigen, heliu și hidrogen, în condiții normale.
Moțiunea moleculară presupunerea întâmplării implică faptul că viteza de o molecule ideale de gaz poate lua orice valoare în intervalul de la 0 la ∞. Maxwell în 1859 găsi teoretic funcția distribuției vitezei și energie, care va permite să se calculeze moleculele Numerele lo într-o unitate de volum de gaz, a căror viteză este în vitezele de interval unitare d # 965; în vecinătatea o viteză predeterminată # 965;. Funcția de distribuție are forma
unde k - este constanta Boltzmann egal cu 1,38 x 10 -23 J / K.
La o anumită valoare a funcției de distribuție a vitezei are maxim (fig. 6.6). Viteza corespunzătoare maximă a funcției de distribuție, numită viteza probabilă
Viteza medie a moleculelor
Viteza rms a moleculelor
Distribuția energiilor moleculare ale mișcării de translație
Odata cu progresul posibil rotație și vibrație a moleculelor. La fiecare grade de translație și de rotație de libertate avem la energia termică de mișcare, oscilând - kT.
Numărul de grade de libertate a obiectului material este numărul de coordonate independente care ar trebui invitate să definească în mod clar poziția obiectului în raport cu sistemul de referință în cauză.
Astfel, ca un punct material în spațiu este determinată de trei coordonate x, y, z. apoi, ea are trei grade de libertate. Corpul solid are șase grade de libertate: coordonatele x, y, z poziția centrului de masă este unghiuri determinate # 952;, # 966; # 968; - rotirea corpului în jurul axei x, y, z.
N sistem material de puncte, între care nu există legături rigide, are 3 N grade de libertate. O molecula diatomica cu o legătură rigidă între atomii de carbon are cinci grade de libertate: trei translație și două rotație.
molecule trei- și poliatomice cu o conexiune rigidă sunt, ca un solid, cu șase grade de libertate.
O molecula diatomica cu legătură elastică între atomii are șase grade de libertate: coordonatele x, y și z definesc poziția centrului de inerție, unghiuri # 952; și # 966; - poziția axei sistemului, l - distanța dintre moleculele.
Distribuția energetică a gradelor de libertate rămâne valabil atâta timp cât energia cinetică a particulelor este o funcție pătratică a vitezei. și potențialul - al unei funcții pătratice a coordonatelor (armonici scăzute).
energie aleatorie mișcare termică a unei molecule
unde i - suma de translație, rotație, și de două ori numărul de grade de libertate de vibrație a moleculei.