Biomoleculelor. Peptide și proteine
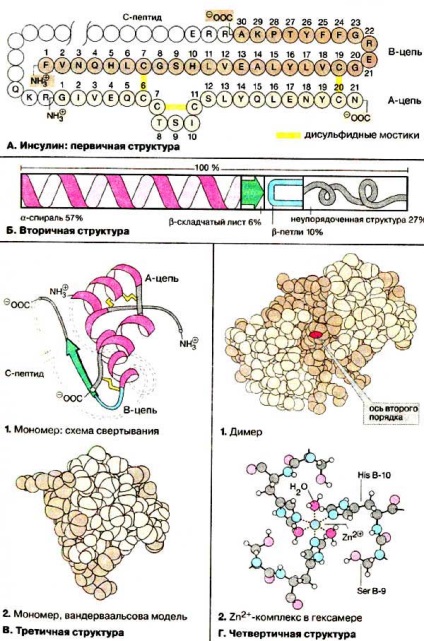
A. Insulina: Structura primară
înțeleagă sub structura primară a secvenței de aminoacizi a lanțului polipeptidic. Insulina a fost prima proteină, a cărei structură a fost complet stabilit la începutul anilor '50. Functional molecula de insulină activă constă din două lanțuri de polipeptide (lanțuri A și B) legate prin legături disulfidice (Schema Un lanț este colorat într-o culoare maro deschis, B-lant - maro închis, punți disulfurice - în galben). punte suplimentară disulfura localizată în interiorul catenei. In pancreas, unde biosinteza insulinei, este sintetizat pentru prima proteină precursoare - proinsulinei. în care restul de aminoacid C-terminal al lanțului B legat c # 925 reziduu-terminal al fragmentului A-lanț 33 membri (schema colorate). După formarea unei punți închise corect proinsulina disulfidice the-peptida C este clivat de enzime proteolitice (vezi. P. 162).
B. Structura secundară
structuri secundare numite regiuni ale lanțului polipeptidic cu o conformație ordonată. stabilizate prin legături de hidrogen (vezi p.. 74). In cele mai multe proteine globulare sunt prezente simultan ambele # 945; helix. și # 946; -skladchatye foi. Mai mult, există porțiuni cu structură dezordonată. Un element structural comun al proteinelor globulare este # 946; o buclă.
Porțiunile moleculei de insulină având forma # 945; helix, 57%, 6% din # 946; -skladchatuyu structura 10 este construit ca% # 946, o buclă, restul de 27% nu au nici o structură ordonată.
B. Structura terțiară
Functional activă conformație tridimensională a proteinelor sunt numite structura terțiară. Structura terțiară a proteinelor examinate în primul rând de cristalografie. Această metodă consumatoare de timp se bazează pe difracție de raze X pe cristale proteice bine formate. bază Ha de modele de difracție calculată distribuția densității electronilor în cristal, iar densitatea de electroni este redus prin structura spațială a moleculelor de proteine cu rezolutie atomica. În prezent, definite structuri tridimensionale a sute de proteine. Cu toate acestea, în timp ce multe proteine nu pot fi studiate prin această metodă, deoarece ei nu pot obține, și cristale de dimensiuni suficient de mari bine formate.
Analiza structurii terțiare a insulinei a arătat că # 913; sunt două porțiuni a catenei scurte, și o catenă B - o singură porțiune lungă, construită sub forma # 945; helix (1). Astfel, capătul N-terminal al catenei și C-terminal al catenei B sunt în imediata apropiere unul de altul. Singurul tip de structură de tablă cutată este formată în dimerul de insulină (vezi. T 4). Structura terțiară a proinsulinei nu a fost stabilită.
Structura cuaternară G.
molecule de proteine formează adesea complecși construite simetric stabilizate interacțiunile nekovalentnych datorate. Aceste complexe sunt numite oligomeri. și unitatea complexelor componente (2 până la 12) - subunități sau monomeri. Insulina formează de asemenea o structură cuaternară. Insulina din sânge parțial prezent ca un dimer (1). Dimerul are o axă de simetrie de ordinul doi. Mai mult, în pancreas ca formă de rezervă conține hexamerul de insulină (6 monomer) stabilizat cu ioni de Zn 2+ (vezi p. 162). Formarea de două complexe cu Zn 2+ resturile de histidină cation iau parte la toate cele șase subunități poziția B-10. Schema 2 arată că fiecare cuprinde un complex octaedrice cation Zn2 +. Trei resturi de histidină și trei molecule de apă (vezi. De asemenea, p. 83).