Experiența pe termen lung cu producția și utilizarea de amoniu se litri, a arătat că, în timp, respectând normele stabilite ammiach Nye nitrat în condiții de siguranță 57
66. Pure azotat de amoniu-ing fără sensibilitate la șoc, impact sau frecare. Cu toate acestea, în anumite condiții, azotat de amoniu proprietăți explozive. Pe această bază, și este utilizat ca materie primă în Ammi de producție - explozivi achno-Selitrennoe. Ei sufla numai pe detonator. Exploziile de azotat de amoniu pur poate fi tu-titluri din detonatorul principal sau de impact, sau descompunerea termică a sării într-un spațiu închis.
Crește exploziv de nitrat de amoniu, în prezența acizilor minerali L materiale ușor oxidabile, cum ar fi materiale organice și anumite metale, în special în formă de stare de pulbere (de exemplu, aluminiu, zinc, plumb, stibiu, bismut, nichel, cupru, cadmiu). In cele mai multe cazuri, în prezență la imputarea acestor metale (în special cadmiu și cupru) format Unst-chivy ușor nitrit de amoniu descompusă.
Odată cu creșterea dimensiunii particulelor și creșterea umidității-Explosion voopasnost azotat de amoniu este redus semnificativ. sare Nye umiditate care conține mai mult de 3% apă, nu explodează, chiar și atunci când explozia 58'5E detonator.
La încălzirea azotatului de amoniu începe să se descompună conform ecuației:
Această descompunere devine semnificativ peste 150 °, dar chiar și la 165 °, pierderea în greutate nitrat de amoniu nu depășește 6% pe zi. La temperaturi mai mari, azotatul de amoniu se descompune intens in-67 prin următoarele reacții: la 200-270 '
(Încălzește aceste reacții sunt de 18 ° și produșii de reacție gazoasă.) Ultima ecuație corespunde descompunerii explozive NH4N03. Descompunerea termică poate NH4N03 pro-vin, în același timp, pentru mai multe reacții, dintre care unul poate domina asupra altora. Descompunerea termică a acidului azotic determină apariția unui produs gazos de descompunere a azotatului de amoniu și N0 NO2. Aparent, aloca-schiesya prin descompunerea termică a acidului azotic și H20 suplimentar NH4NO368 catalizeaza N02 descompunere. Descompunerea termică a azotatului de amoniu topit ryaetsya exprimă check-in prezența compușilor SG6 +, Cr3 +, Cr2 +, și altele. 69. one-way Kim, azotat de amoniu pur ar trebui cu siguranță transporta pe o clasă de substanțe potențial explozive.
azotat de amoniu, care sunt stocate în depozite deschise, nu suflare Xia, chiar și în cazul unui incendiu grav. Incendiile de asemenea amoniu celite-ry care a avut loc în spații închise, de exemplu, în co-rabelnyh deține, containere și așa mai departe. N. Încheiat explozie de obicei puternic. Se crede că descompunerea termică a deșeurilor de amoniu nu la presiunea atmosferică se produce altfel decât sub o presiune ridicată, la care viteza de descompunere a mo-Jette fie mai rapid și să producă mari cantități de produse gazoase diferite. 64 a fost demonstrat existența unei presiuni „limita“ (aproximativ 6 atm) după care sub-respectiv vine la temperatura de descompunere explozivă a azotatului de amoniu.
Pe de altă parte, inflamabilitatea ușor și de azotat de amoniu exploziv, fiind în interior neventilate, nu se poate explica creșterea presiunii totale, care este cauza secundară, precum și acumularea de produse miere-lennogo descompunere nitrat. Spontan descompunere am nitrat miachnoy în prezența oxidabile, de exemplu, substanțe organice este avtokatalitichesknm. O astfel de descompunere tensiune poate provoca incendii și explozii. Te-autocataliză este numit în principal format prin descompunerea dioxidului de azot NH4N03 de asemenea, dar într-o măsură mai mică, a vaporilor de apă. In acest ultim circumstanță indică neacceptabilitate Sun-stingere nitrat flacără de abur.
Stabilizatori pentru a preveni descompunerea spontană de azotat de amoniu-tensiune poate fi format în timpul lianții acidul său descompunere azotic, și NO2, sau NH4N03 ai fisionabil prin reacția cu amoniac. În sfârșit, centralizează acid azotic și restaurează oxizi de azot la azot elementar. Stabilizatorii sunt, de exemplu, carb-amidă (0,05-0,1% în greutate nitrat de amoniu), carbonat de calciu 7073 sau mage-TION (5%), cloruri și dr.67 metenamină.
TOC o "1-3" h z În cazul azotatului de amoniu. 1
sulfat de amoniu. 1.3
azotat de calciu. 1.5
Azotatul de amoniu are un potențial de aciditate (fiziologică). Fiziologic neutralizat de amoniu se litri preparat prin fuziunea cu calcar, dolomit și Dru-gimi materialami76. Explozie de azotat de amoniu antiaglomerant a avut loc din nou producția în țările capitaliste. Numai în perioada de după război, pe baza experienței de succes a URSS, mai întâi în Statele Unite și apoi în alte țări, utilizarea azotatul pe termen ammiach ca îngrășământ cu azot a fost pe larg timp vitie.
Azotatul de amoniu este utilizat pentru fabricarea explozivilor - amoniți (amestecuri de nitrat de amoniu cu materiale organice - lemn, șrotul și alte tipuri de faina cu adaos de nn - troproduktov)., Ammonalov (amestecuri conținând aluminiu în roshok) etc. Pentru aceste scopuri, produc CE impermeabil 77 litri
Compoziția de nitrat de amoniu este prezentat în Tabelul. 89.
Compoziție nitrat de amoniu (în%)
Când ambalare Temperatura nu trebuie să fie azotat de potasiu mai mare de 50 °.
Este ambalat în saci de hârtie bituminoase (trei ----------------
Pyatnsloynye), precum și în meshki80 plastic. Amoniu grad nitrat B, utilizat în agricultură și industriale-Ness trebuie sa fie sfărâmicios. Friabilitatea este determinată de o singură picătură de oricare cinci pungi azotatul de plat pe podea de la o înălțime de 1 m, urmat de sitare pe o sită este de 5 mm.
În timpul cernerea nitrat ar trebui să treacă în întregime printr-o sită; reziduu de cernere permis individuale forfetara Mykh ușor strivit de mână.
Materii prime și metodele de producție
Producerea de azotat de amoniu cuprinde neutralizarea acidului azotic cu ammiakom81-84 gazos și cristalizarea produsului. Amoniacul nu trebuie să conțină mai mult de 1% umiditate; nu este permisă prezența uleiului.
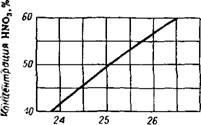
Căldura de neutralizare knal / nh g-mol ^ Nos
Fig. 341. Căldura de neutralizare a acidului azotic cu am MIAK gazos (la 1 atm n 18 °).
Concentrația acidului azotic durează mai mult de 45% HN0385; Deținător de stoc oxizi de azot nu trebuie să depășească 0,1% în ea. Pentru un nitrat de radiație amoniu mo-gut fi de asemenea utilizat la producție- mișcări amoniacal de exemplu apă de amoniac și gazele de tancuri și purjare sunt conduse afară din depozitarea amoniacului lichid și produs cu sisteme de sinteză a amoniacului pro-duvkah. Rezervorul de gaz compoziție: 27 45-70% NH3, 55-30% H2 + N2 (cu urme -
Ni metan și argon); pro-structura duvochnyh gazelor: 7,5-9% NH3, 92,5-91% H2 + N2 (cu urme de metan și argon). s
Mai mult, pentru producerea de nitrat de amoniu, folosit, de asemenea, gazele de distilare a ureei; compoziția aproximativă: 55-57% NH3, C02 18-24%, 15-20% H20 86.
Efectul termic al NH3 + NK03 reacție (g.) (R.) -> NH4N03 stavlyaet co-35,46 kcal / g-mol. În producția de azotat de amoniu este de obicei folosit acid -ing 45-58%. În acest caz, reacțiile efect de neutralizare termică redusă în mod corespunzător cu cantitatea de căldură diluarea acidului azotic cu apă, iar cantitatea de căldură de dizolvare de nitrat de amoniu (Fig. 341). Când utilizări ra țional au evoluat căldura de neutralizare poate fi obținută prin curse concentrate evaporare de apă și chiar crează topi de nitrat de amoniu (Fig. 342) 87.
În conformitate cu acest circuit distincție pentru a obține o soluție de azotat de amoniu, urmată de evaporare la ea (așa numitul proces multi-Du-) și pentru a da o topitură (odnosta-diyny sau proces bezuparochny).
Pentru a selecta o schemă de neutralizare rațională URSS au fost testate patru scheme fundamental diferite de nitrat-ammiach clorhidric folosind Transatlantice la neytralizatsii88 „101:
instalații care funcționează la presiune atmosferică (suc de abur de presiune manometru 0,2at 0,15);
Montarea cu vid se evaporă Lema;
Lucrări de instalare de sub presiune, cu suc de căldură un singur ispol'uet mations cu abur;
Lucrări de instalare de sub presiune, cu un dublu-vaniem utilizează suc de căldură cu abur (concentrate în topitură luchenie).
În practica industrială în curs de largă aplicare ca NAI-instalare mai eficientă început de topire sub presiune atmosferică, folosind căldură-tralizare și instalarea acestuia cu parțial evaporator cu vid.
Prin reacția clorit de sodiu cu clor are loc Obra mations-clorură de sodiu și dioxid de clor este eliberat: 2NaC102 + C12 = 2NaCI + 2 SYU2 Această metodă a fost anterior pentru a obține dioxid de bază ...
Fig. 404 prezintă schema de producție diammonitro - Fosco (tip TVA). concentrația de acid fosforic de 40-42,5% P2O5 colector 1 pompa 2 este alimentat la 3 din cutia de capăt în mod continuu cerned-Koto ...
Proprietățile fizico-chimice ale sulfat de amoniu (NH4) 2S04 - cristale incolore rombiche forma XYZ cu densitate 1,769 g / cm3. sulfat tehnic ammo-TION are o tentă gri-gălbuie. La încălzirea sulfatul de amoniu se descompune cu pierderea de amoniac în curs de dezvoltare ...