2. Mobilitatea ionilor
conductibilitate electrolit asociat la o viteză de mișcare TION ionilor săi într-un câmp electric. Pentru a calcula Elektroprom-conductivitate suficientă pentru a contoriza numărul de ioni care trec prin orice secțiune transversală a vasului electrolitic, în unitatea de timp în condiții standard, adică. E. La o intensitate a câmpului de 1 V / cm. .. Deoarece energia electrică este realizată de ioni-TION caractere diferite, se deplasează în direcții opuse, cantitatea totală de energie electrică care trece printr-o soluție de 1 sec, adică, puterea curentului I, suma cantităților de energie electrică, respectiv a migrat cationi și anioni I + I-:
Notăm viteză și cationi prin „(în cm / sec), viteza de deplasare a anionilor prin v“ (în cm / sec) echivalent cu con-centrarea ionilor prin CI (în g-eq / cm3), secțiunea transversală Cilindrul de vas cilindric prin q (în cm), distanța dintre electrozi prin l (în cm), iar diferența de potențial între electrozi prin E (în V). Contam numărul de cationi se extind vedere în secțiune transversală Th-tăiat de electrolit 1 sec. În acest timp, o parte a secțiunii transversale vor fi toate cationilor erau la momentul inițial, la o distanță și nu mai mult decât „vezi secțiunea selectată, adică. E. Toate cationii în u'q vrac. Număr cationi n +. care trece prin secțiunea transversală 1 sec:
Deoarece fiecare gram echivalent de ioni transportă în conformitate cu legea lui Faraday F = 96485 K de energie electrică, curentul (în):
Pentru anioni viteză egală cu v“, susținând în același mod, obținem
Pentru un curent total (concentrațiile de ioni echivalente sunt aceleași, adică c + = = CI .. c-):
Și viteza de mișcare ion „și V“ depinde de natura ionilor, pe câmp de intensitate E / l, concentrația, temperatura, și vâscozitatea medie t. D.
Să presupunem că toți factorii cu excepția intensității câmpului este constantă, iar viteza ionilor în lichid este constantă în timp, la o forță aplicată constantă dacă mediul în care acestea sunt mișcare zhutsya posedă viscozitate suficientă. Prin urmare, putem presupune că viteza ionilor este proporțională cu forța aplicată, adică intensitatea câmpului ..:
unde coeficienții de u și v-proporționalitate care sunt egale cu viteza ionilor la o intensitate a câmpului de 1 V / cm.
Valorile u și v sunt numite mobilitatea absolută a ionilor. Acestea sunt măsurate în cm 2 / (s · c).
Substituind (25) în ecuația (24), un semi-cpm
Substituind în ecuația (27), valorile K și echivalarea laturile dreaptă a ecuației (26) și (27) avem:
Rezolvarea ecuației (28) în ceea ce privește # 955;, obținem
Pentru electroliți puternici, disociere care este considerată completă, raportul din 1000 CI / c = 1; Electroliții slabi 1000 CI / c = # 945;. Prezentăm o nouă notație:
și apelați valoarea U și mobilitățile V ion. Apoi, pentru electroliți puternici
și pentru electroliții slabi
# 955; = (U + V) # 945; (32)
La diluție infinită (m. E. În timpul # 966; → ∞, U → U∞. Și V → V∞ # 945; → 1), obținem
atât de electroliți puternici și slabi. magnitudine U∞ și V∞. sunt în mod evident limitează mobilitatea ionilor. Ele sunt conductivitate de cationi și ani-un echivalent separat la diluție infinită și sunt măsurate în aceleași unități care # 955; sau # 955; .. ∞ adică în cm2 / (ohm • g-eq). Ecuația (33) este o expresie a legii K.olrausha: echivalent-valență conductibilitate la infinit timp administrată egal cu mobilitati marginale ale ionilor.
Mobilitate U și V în ecuația (32) depinde de concen-înre (diluție), în special pentru electroliți puternici la concentrații mari în cazul în care U și V valori mai mici de U∞ și V∞. în creștere datorită coeziunii reciproce a ionilor de semne opuse (influența atmosferei ionice). La fel se procedează pentru electroliții slabi, dar într-o măsură mai mică, deoarece există concen-trarea ionilor este mic.
Trebuie amintit că valoarea U și V (și, în consecință, U∞ și V∞) aparțin 1 g - echivalente ale acestor ioni.
Mobilitatea este o caracteristică esențială a ionilor de-furie implicarea lor specifică în electric de electroni-trolita.
În soluții apoase, toți ionii cu excepția ionilor H3 O + și OH -. Ea are aceeași ordine de mobilitati. Aceasta înseamnă că mobilitatea absolută ion (u și v) -De asemenea, același ordin de mărime egală cu câțiva centimetri pe oră (K + -2,5; OH - - 4,16; H3 O + - 10 cm / h).
În cazul în care ionii sunt pictate, mișcarea lor în anumite condiții de separare condiți pot fi măsurate direct determinate și astfel mobilitatea absolută injectare.
Folosind tabelul limiteaza mobilitatea ionilor și legea Kohlrausch, se poate calcula cu ușurință limita-ing conductivitatea electrică a soluțiilor respective.
Conductivitatea echivalentă a soluțiilor de sare exprimate în cantități de ordinul 100-130 cm2 / (g echivalent • ohmi). Având în vedere valorile de mobilitate hidroniu ioni excepționale de mare telno # 955; ∞ acizi pentru 3-4 ori mai mult # 955; ∞ pentru săruri. Alkali ocupă o poziție intermediară.
mișcare de ioni poate fi comparată cu mișcarea mingii macroscopic-cer într-un mediu vâscos și să se aplice în acest caz Stokes formula:
unde e este sarcina electronului; z-numărul de taxe elementare de ioni; r-eficiente rază a ionului; # 951; - coeficient de vâscozitate; E / 1 - intensitate a câmpului.
O forță motrice - intensitatea câmpului electromagnetic E / 1, la calcularea ab accepta lutely mobilităților egal cu unitatea. Prin urmare, telno vitezei de mișcare ion este invers proporțională cu raza lor. Luați în considerare numărul de Li +. Na +. K +. Deoarece numărul specificat de adevărate raze de ioni crește, mobilitatea trebuie redusă pentru a se potrivi cu aceeași secvență. Cu toate acestea, în actu-Ness nu este. Chiva-mobilitate luate în urma trecerii de la Li + K + aproape sa dublat. Din aceasta putem concluziona că în soluție și într-un ioni cu zăbrele ionice au raze diferite. Mai mică de noroi ( „cristal-chimic“) Raza de ioni IC, cu atât mai mare raza efectivă în electrolit. Acest fenomen poate fi explicat prin faptul că ionii din soluția nu sunt libere, ca hidratat sau (în cazul de față ob) solvatate. Apoi eficienta ionul gama alunecatoare schegosya în câmpul electric va fi determinată în principal de gradul de hidratare, adică. E. Numărul asociat cu moleculele de apă ion-mo.
Ionii de comunicare cu molecule de solvent, în special moleculele de apă, ion-dipol, și deoarece intensitatea câmpului la suprafața ionul de litiu este mult mai mare decât pe suprafața ionului de potasiu (pentru suprafața inferioară a primei suprafețe a doua, iar raza, r. F. distanta de la dipolii apă single-AF-eficiente ef în centrul ionului este mai mic), gradul de hidratare al litiu ion mai mare grad de hidratare a ionului de potasiu. Conform formulei lui Stokes, înmulțiți perceput ionii ar trebui să aibă o mai mare mobilitate-Ness decât încărcată individual. Velocity de ioni cu sarcină multiplă sunt puțin diferite de viteza de circulație a încărcat individual, ceea ce este, evident, din cauza mai mare de hidratare-ste Peña datorită puterii lor mai mare a câmpului generat de ioni cu sarcină multiplă.
Trebuie reamintit faptul că aplicabilitatea formulei Stokes a ionilor separate, insuficient motivată. Stokes formula descrie miscarea mingii într-un mediu continuu. Solventul nu este ion astfel de mediu, însă toate rezultate catîrii VOR concluzii Stokes în ceea ce privește hidratarea ionilor, sunt doar calitative și se pare că sunt utile în estimarea audio mișcare stvennoj numai ieșire mare tip sferic ion N (C4 H9) 4 +.
Informații despre „conductivitatea electrică a electroliților“
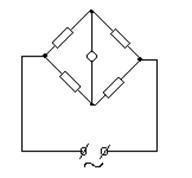
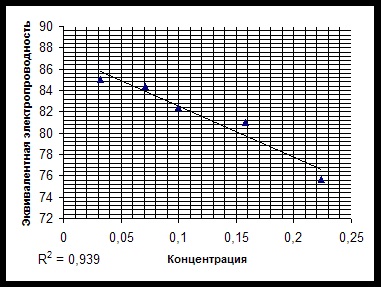
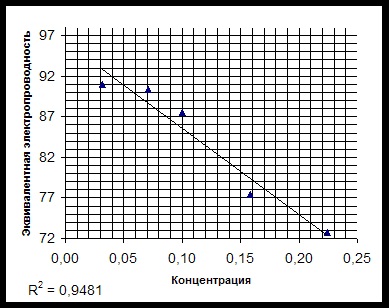
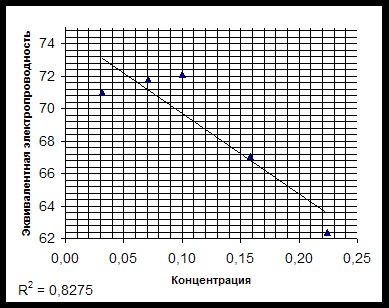
la conductorii de al doilea tip, care sunt caracterizate prin conductivitate ionică. Scopul acestui studiu este de a determina conductivitatea echivalentă a lizinei și stabilirea conductivității echivalente în funcție de concentrație. Revizuirea măsurii literaturii de capacitatea unei substanțe de a conduce un curent electric este.