ecuația 2.6-Ion molecular
Atunci când orice neutralizanți puternic orice bază puternică de acid pentru fiecare mol de apă formată se alocă aproximativ 57,6 kJ de căldură:
HCl + NaOH = NaCl + H2O + 57,53 kJ
H + + Cl - + Na + + OH - = Na + + Cl - + H2O
Considerând ecuația rezultată, vedem că în timpul reacției ionii de Na + și Cl - nu sa schimbat. De aceea, rescrie din nou, eliminând acești ioni din ambele părți ale ecuației. obținem:
Prin urmare, orice reacție de neutralizare a unui acid tare cu o bază puternică, în orice cantitate aceluiași proces - moleculele de apă în formarea de ioni de hidrogen și ioni de hidroxid. Este clar că efectele termice ale acestor reacții, de asemenea, ar trebui să fie la fel.
Strict vorbind, reacția de formare a apei de ioni este reversibil, care poate fi exprimată prin ecuația
H + + OH - ↔ H2O
Cu toate acestea, după cum vom vedea mai jos, apa - electrolit foarte slab și disociază doar într-o măsură neglijabilă. Cu alte cuvinte, echilibrul dintre moleculele de apă și ionii deplasate puternic spre formarea de molecule. Prin urmare, aproape reacția de neutralizare a unui acid tare cu o bază puternică continuă până la sfârșit.
Atunci când amestecarea unei soluții a unei sări de argint cu acid clorhidric sau cu o soluție de oricare dintre sarea sa este formată întotdeauna o caracteristică Curdy alb clorură de argint precipitat:
Reacții similare sunt de asemenea reduse la un singur proces. Pentru a obține rescriere sale ecuație ion molecular, de exemplu, ecuația primei reacții, înregistrând electroliți puternici, ca în exemplul anterior, în formă ionică, iar substanța situată în precipitat în molecular:
După cum se arată, ionii H + și NO3 - nu se schimbă în timpul reacției. Prin urmare, noi le excludem și rescrie-l din nou:
Ag + + C1 - = AgCl ↓
Aceasta este ecuația-ionic al procesului.
Trebuie să existe, de asemenea, amintit că precipitatul de clorură de argint este în echilibru cu ionii Ag +, și C1 - soluție, astfel încât procesul exprimat de ultima ecuație, este inversabil:
Ag + + C1 - ↔ AgCl ↓
Cu toate acestea, datorită solubilității scăzute de clorură de argint, acest echilibru este deplasat puternic spre dreapta. Prin urmare, putem presupune că reacția AgCI de formare a ionilor practic a ajuns la final.
formarea unui precipitat AgCl va avea loc ori de câte ori o solutie va fi o concentrație semnificativă de ioni de Ag + și C1 - .Poetomu folosind ioni de argint poate fi detectată în prezența ionilor C1 în soluție - și, invers, prin utilizarea ionului de clor - prezența ionilor de argint; ion C1 - poate servi ca un reactiv pe ion Ag +. și ion Ag + - reactiv ion la C1.
În viitor, vom utiliza intens ion molecula forma ecuațiile reacțiilor cu electroliți.
Realizat de ecuații ion molecula trebuie să știe care sunt săruri solubile în apă și care este practic insolubil. Caracteristicile generale ale solubilității în apă a celor mai importante sare este dată în tabelul 2.
-Ion molecular ecuație pentru a ajuta să înțeleagă caracteristicile reacțiilor dintre electroliți. Să considerăm, de exemplu, de câteva reacții care au loc cu acizi slabi si baze.
Tabelul 2. Solubilitatea sărurilor majore în apă
Anionii și cationii
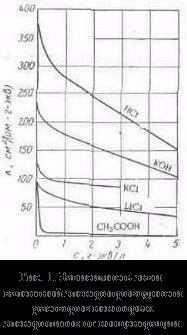
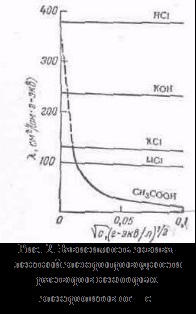
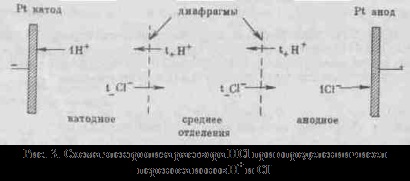
cu alți solvenți, considerăm că rennye modele sunt stocate, dar există abateri de la ele, de exemplu, pe curbe # 955; c este adesea observată cel puțin (o conductivitate electrică anormală). 2. Mobilitatea ionilor asociază electrolit conductivitatea la o viteză de mișcare TION ionilor săi într-un câmp electric. Pentru a calcula Elektroprom-conductivitate suficient pentru a contoriza numărul de ioni.

cu recuperare de oxigen - privarea de oxigen. Odată cu introducerea conceptului reacțiilor redox reprezentări de chimie electronice au fost extinse la o reacție în care oxigenul nu participă. In anorganica reacție chimie redox (IAD) poate fi formal considerată ca deplasarea electronilor dintr-un atom de reactant (agent de reducere) la un alt atom (.
studiul sintezei de noi materiale și procese de transport ionic în ele. În formă pură, astfel de modele pot fi identificate mai clar în studiul de cristal unic electrolit solid. În același timp, utilizarea electroliti solizi ca medii de lucru elementele funcționale trebuie să fie luate în considerare faptul că materialele au nevoie de un anumit tip și formă, cum ar fi o ceramică densă.
17-25 kg / t de alaun TION care
10-15 kg / m mai mare decât rezultatele pentru alumina dog-chanogo. Alumina utilizată pentru producerea aluminiului, să conțină cantitatea minimă de compuși de fier, dioxid de siliciu, metale grele, cu un potențial de evacuare inferior la catod decât aluminiul, deoarece ele sunt ușor reduse și tranzițiile DYT la catod de aluminiu. Indezirabilă ca prezența în.