Substanța cea mai importantă și comună pe planeta noastră, desigur, apă. Ce se poate compara cu ea în importanță? Este cunoscut faptul că viața pe Pământ este posibilă numai odată cu apariția de lichid. Deoarece apa este un produs (oxid de hidrogen), dintr-un punct de vedere chimic? Ce este și ce proprietăți? Încearcă să înțeleagă acest articol.

Hidrogen și compușii săi
Cel mai simplu atom în întregul sistem periodic - hidrogen. El deține o poziție dublă, situată în subgrupul de halogeni, precum primul grup și metale alcaline. Ceea ce explică astfel de caracteristici? Structura sa cochilie electronic al unui atom. El are un singur electron, care poate fi ușor ca concediu, și să se atașeze o alta, formând o pereche, și completarea stratului exterior.
Acesta este motivul principal și numai gradul de oxidare a elementelor 1 și -1. Acesta reacționează cu ușurință cu metale care formează hidruri - involatil compus solid de sare cum ar fi de culoare alba.
Cu toate acestea, de asemenea, generează cu ușurință molecule de hidrogen și substanțe volatile care interacționează cu nemetale. De exemplu:
In general, hidrogenul compusi genereaza suficient. Cu toate acestea, cea mai importantă substanță, care este inclus, este oxidul de hidrogen a cărui formulă H2O Acesta este un compus cunoscut care recunoaște formula chiar elev de școală primară, care nu sunt încă familiarizați cu chimia. După apă (și acest lucru este cel mai mare oxid de hidrogen) - nu este doar o substanță comună, dar, de asemenea, sursa vieții pe planeta noastră.
Însuși numele elementului reflectă esența ei principal - hidrogen, adică „dând naștere la apă.“ Ca orice alt oxid, activ, de asemenea, este un compus binar având un număr de proprietăți fizice și chimice. Mai mult, există caracteristici speciale care deosebesc apa de toți ceilalți compuși.
O altă clasă importantă de compuși care formează hidrogen sunt acizi, organici și minerale.

Proprietățile chimice ale hidrogenului
Din punctul de vedere al reactivității, hidrogenul - agent de reducere suficient de puternic. În multe reacții arată doar astfel de proprietăți. Cu toate acestea, interacțiunea cu un alt metal mai puternic, devine oxidant.
Foarte important în industrie este reacția hidrogenului cu oxizi metalici. Este o modalitate de a obține cele mai recente într-o formă pură. Vodorodotermiya - o metodă metalurgic pentru sinteza oxizilor metalici puri prin reducere cu hidrogen.
Reacția cu oxid de hidrogen are următoarea formă generală: Mex Oy + H2 = H2O Me +.
Desigur, acest lucru nu este singura metodă pentru sinteza metalelor pure. Sunt alții. Cu toate acestea, reducerea hidrogenului oxizilor - procesul de fabricație suficient energetic favorabil și simplu care a găsit aplicarea pe scară largă.
De asemenea, interesant este caracteristica care atunci când este amestecat cu aerul, hidrogenul gazos poate forma un amestec exploziv puternic. Numele său este detonatoare de gaz. În acest scop, amestecarea trebuie făcută la rata de două volume de hidrogen la un atom de oxigen.
Apa - oxid de hidrogen
Faptul că oxidul este foarte important, am menționat deja de mai multe ori. Acum, să ne-l caracterizează în termeni de chimie. Este acest compus face parte din această clasă de substanțe anorganice?
Pentru a face acest lucru, încercați să scrie o formulă puțin diferită: H2O = HOH. Linia de jos este același cu numărul de atomi din prima, cu toate acestea, este clar acum că ne confruntăm cu un hidroxid. Ce proprietăți ar trebui să-l aibă? Luați în considerare disocierea compușilor:
Prin urmare, proprietățile acidului, ca în soluția de cationi de hidrogen. Pe langa principalele ele nu pot fi doar formate după metale alcaline.

De aceea, un alt nume care are oxid de hidrogen - oxyacid compoziție foarte simplu. Odată ce această caracteristică țesătură complexă a unei molecule date, în consecință, proprietățile sale vor fi speciale. Și proprietăți sunt respinse din structura moleculei, deci și analiza.
Structura moleculei de apă
- Molecula de apă - un dipol, deoarece elementele din cadrul structurii sale diferă foarte mult semnificativ electronegativitate.
- Forma sa este triunghiulară, la baza - hidrogen, iar la partea superioară - oxigenul.
- Datorită acestei structuri, substanța capabilă să formeze legături de hidrogen între aceleași molecule, și alți compuși având o compoziție puternic element de electronegativ.
Vezi ca vizualizat hidrogen arată schematic oxid, poate fi ilustrat mai jos.
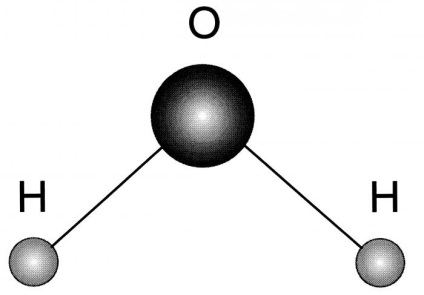
Proprietățile fizice ale oxidului de hidrogen
unele trăsături caracteristice de bază pot fi descrise.
- Formă: gazoasă - vapori, lichid, solid - zăpadă, gheață.
- Punct de fierbere - 100 0 C (99.974).
- Punct de topire - 0 0 C.
- Apa se poate contracta atunci când este încălzit în intervalul de temperaturi de 0-4 0 C. Aceasta explică formarea gheții pe suprafață, care are o densitate mai mică și conservarea vieții sub un strat de oxid de hidrogen.
- Valoarea ridicată a capacității calorice, conductivitatea termică cu toate acestea, foarte scăzută.
- În stare lichidă prezintă o oxid de hidrogen vâscozitate.
- O anumită proprietate poate fi numită tensiunea superficială și formarea potențialului electric negativ la suprafață.
Așa cum am menționat mai sus, în special proprietățile depind de structura. Deci, este aici. Capacitatea de a forma legături de hidrogen a condus la caracteristici similare ale compusului.
oxid de hidrogen: Proprietăți chimice
Din punctul de vedere al chimiei, activitatea apei este destul de mare. Mai ales atunci când vine vorba de reacții, însoțite de încălzire. Ce este capabil să reacționeze hidrogen oxid?
- Cu metale, care sunt în tensiunile rând de hidrogen. Astfel, cel mai activ (Al) nu necesită condiții speciale, și au o putere de reducere mai mic pentru a reacționa doar cu abur. Cei care sunt, după hidrogen, nu sunt în măsură să se angajeze în astfel de interacțiuni.
- Cu nemetale. Nu toate, dar cele mai multe. De exemplu, într-o atmosferă de apă fluor arde violet cu flacără. De asemenea, reacția poate fi clor, carbon, siliciu și alți atomi.
- Cu oxizi metalici (de bază) și acid (nemetale). Sunt formate, respectiv, alcali și acizi. Printre metalele pentru astfel de reacții reprezentanți capabili din primele două grupe principale de subgrupe, cu excepția beriliu și magneziu. Nemetale care formează oxizi acizi reacționează cu toată apa. Excepția este nisip de râu - SiO2.
Reacțiile Ecuație oxid de hidrogen ca un exemplu, următoarele: SO3 + H2O = H2 SO4.

Distribuția în natură
- Aproximativ 70% din greutatea corpului uman și a mamiferelor. Unele oxid faună compus din hidrogen aproximativ 98% (meduze).
- 71% din Pământul acoperit de apă.
- Greutatea maximă a apei oceanelor.
- Aproximativ 2% este conținută în ghețari.
- 0,63% este concentrată în sol.
- 0,001% din atmosfera (ceață).
- corpul vegetal este constituit din 50% apă, unele specii chiar mai mult.
- Mulți dintre compușii se găsesc în formă cristalină, care conține apă legată.
Continua lista poate fi lung, deoarece greu să-și amintească ceva, o parte care nu include apa sau atunci când nu este inclus ceva. Sau format fără implicarea oxidului.

Metodele de preparare
Valoarea industrială Prepararea nu are oxid de hidrogen. La urma urmei, mai ușor de utilizat surse gata făcute - râuri, lacuri și alte corpuri de apă decât să-și petreacă o mare cantitate de energie și substanțe chimice. Prin urmare, în laborator este relevant numai obținerea distilată, apă ultrapură.
Pentru aceste scopuri, utilizați aparate specifice, cum ar fi imagini statice. este necesară o astfel de apă pentru multe reacții chimice, deoarece brut conține cantități mari de impurități, săruri, ioni.
Rolul biologic
Pentru a spune că apa este folosit peste tot, nu spun nimic. Este de neconceput să ne imaginăm viața fără această conexiune. De dimineața devreme până noaptea târziu oamenii sunt în mod constant că atât utilizarea în scopuri casnice și industriale.
Proprietățile oxidului de hidrogen implică utilizarea acesteia ca solvent universal. Și nu numai în laborator. Dar, de asemenea ființe vii, unde fiecare al doilea loc cu mii de reacții biochimice.

De asemenea, apa este ea însăși un participant la mai multe sinteze, ea servește, de asemenea, ca un produs secundar care rezultă din acestea. Fiecare persoană din lume timp de 60 de ani, trece prin ea însăși la aproximativ 50 de tone de acest material uimitor!
hidrogen cu oxid este utilizat:
- în toate industriile;
- medicament;
- sinteză chimică;
- în toate tipurile de industrii;
- necesitățile casnice;
- agricultura.
Este dificil de a determina zona vieții în care se poate trăi fără apă. Numai ființele care nu au oxid de hidrogen în compoziția sa vie și să trăiască fără ea, sunt viruși. Acesta este motivul pentru care un om dificil să se ocupe de aceste organisme.
