După cum sa menționat anterior, forțele intermoleculare noncompensation la rezultatele de interfață în formarea în apropierea suprafeței câmpului de forță. Ca rezultat, stratul de suprafață trebuie să se concentreze componente, scăderea sistemului energetic în ansamblu. Acest fenomen de creștere spontană (modificare) a concentrației componentei în stratul de suprafață, în comparație cu faza în vrac, numită adsorbție. Forța motrice a procesului de adsorbție este tendința sistemului de a reduce tensiunea de suprafață. Distinge adsorbție gaz pe o adsorbție solidă de substanță dizolvată la soluția - iar gazul la solid - soluție. Trebuie remarcat faptul că, datorită existenței suprafeței de energie în exces nu este numai adsorbție, ci și udarea suprafeței, lichidul de etalare pe suprafața fenomenelor capilare.
Substanța, pe a cărui suprafață se produce adsorbția se numește adsorbant. care poate fi absorbită din -adsorbtivom fază în vrac. și deja absorbit - adsorbat. O măsură cantitativă a adsorbției i-lea component Gibbs, este definită ca fiind cantitatea în exces (în moli) de componentă per suprafață interfacială unitate, cel mai adesea ca un mol / m 2. În practică, suprafața nu este cunoscută întotdeauna și datele de adsorbție este exprimată ca numărul de gaz adsorbit pe unitate de greutate a adsorbantului, de exemplu, mol / g. Din aceasta rezultă că crește odată cu creșterea adsorbtie finețe a fazei solide a adsorbantului, astfel încât cel mai important parametru este suprafața specifică, și anume suprafață per greutate unitate adsorbtiv disponibil.
Procesul invers de adsorbție, apel desorbție. Dacă gazul pătrunde în volumul adsorbantului, procesul se numește absorbție. iar în cazul în care mecanismul nu este cunoscut, un termen general folosit - sorbție.
În funcție de forțele de interacțiune dintre moleculele de adsorbat și adsorbante suprafață distinge adsorbție fizică (physisorption) și adsorbție chimică (chemisorption). Adesea, ele constau în două etape succesive ale unui singur proces de sorbție. Adsorbția fizică și chemisorpția termodinamic pot fi distinse, dar caracterizate prin valori diferite ale diferențiala căldura molară de adsorbție.
adsorbția fizică este cauzată de non-specifice (generice) forțe intermoleculare, în principal, prin forțe van der Waals. Caracteristica distinctivă a adsorbției fizice inversabil, care este cauzată de valori scăzute ale căldurii de adsorbție (4-40 kJ / mol sau 1 - 10 kcal / mol). Prin natura lor, aceste interacțiuni sunt de tip electrostatic interacțiunile dipol-dipol, și includ:
a) forțe de dispersie generează oscilații sincrone care interacționează dipoli - tipice pentru adsorbția moleculelor nepolare (N2 H2 O2 și gaze inerte) la adsorbanți nepolari (cum ar fi grafit și cărbune); ..
b) forțele de inducție generate de interacțiunea dipolului la celălalt le-a indus dipol - tipic pentru adsorbția moleculelor nepolare (N2 O2 H2 și gaze inerte) pe adsorbanți polare cu ionice (cum ar fi SiO2 Al2 O3, etc.) și pentru adsorbția polar .... molecule (H2O, NH3 și CO2, etc ...) pe un adsorbant nepolar și metalele;
c) forțele de orientare a generat orientarea reciprocă a dipolii care interactioneaza. - caracteristic pentru adsorbția moleculelor polare (H2O, CO2, NH3, etc.) în adsorbanți polare cu ionice (cum ar fi SiO2, etc) .....
De asemenea, dipol-dipol, o adsorbție fizică care implică ion-dipol și quadrupole interacțiune.
Chemisorpția invers - este ireversibilă și se caracterizează prin efecte termice ridicate (40 - 400 de kJ / mol și 10 - 100 kcal / mol) au determinat formarea de compuși chimici de suprafață, cu o legătură de valență. Chemisorpția reprezentată uneori ca reacție chimică bidimensională, care nu se extinde dincolo de stratul de suprafață. De exemplu, prin chemisorption oxigenului pe suprafața filmului produse de reacție formate din fier sau aluminiu - oxid, care protejează metalul de oxidare în continuare.
Între adsorbție fizică și chimică cazuri intermediare există, de exemplu, datorită adsorbției legături de hidrogen. Legătura de hidrogen, în contrast cu Van der Waals, este specific, și anume, local, deoarece datorită nonvalent reacția dintre hidrogen grupe donor de protoni (OH, NH2. COOH), cu atomi electronegative de O, N, F, S, CI, având o pereche de electroni unshared (proton acceptorii). Legarea hidrogenului asigură adsorbția moleculelor polare (H2O, CO2. NH3 etc.) Pe suprafața adsorbanților cu grupările hidroxil OH sau oxigen (cum ar fi pahare, geluri de silice și zeoliti). Distribuția densității de electroni în grupele de hidroxil este ferm conectat cu atomii de siliciu-oxigen ale miezului, astfel încât o sarcină negativă în aceasta este deplasată la un atom de oxigen. Prin urmare, o grupă hidroxil OH reprezintă un dipol electric cu pozitiv-negativ-taxa de la un atom de hidrogen, o perioadă prelungită în exterior.
Această sarcină pozitivă și asigură comunicarea cu sarcinile negative ale altor molecule, cum ar fi moleculele de apă. Aceasta se datorează acestor proprietăți ridicate de sorbție în raport cu H2O în pahare, geluri de silice (geluri de silice H2 SiO3) și zeoliți (aluminosilicați cristalini ai metalelor alcaline și alcalino-pământoase).
Adsorbția fizică molecula adsorbit își păstrează structura sa, fără a pierde identitatea, t. E. Molecula și adsorbantul sunt subsisteme independente asociate forțe slabe ale Van der Waals. Deoarece puterea de obligațiuni intermoleculare este mic, molecula adsorbit fizic poate fi relativ ușor îndepărtate de pe suprafață.
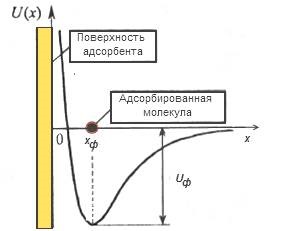
Diagrama de energie Fig.3 pentru procesul de adsorbție fizică pe o suprafață solidă
Starea de energie a particulelor adsorbite sunt luate pentru a reprezenta într-o diagramă U (x), care arată dependența energia unei particule care interacționează cu o suprafață solidă distanța față de această suprafață. La starea de echilibru energetic diagrama corespunzătoare poziției moleculelor de adsorbtie fizice în potențial adâncimea bine UO situate la o distanță față de suprafața kph. Valoarea uf determinată de forța de interacțiune a moleculei cu o energie de suprafață numită adsorbție fizică. Acest proces vine întotdeauna cu eliberarea de energie sub formă de căldură physisorption:
în cazul în care NA - numărul lui Avogadro.
Molecula adsorbite reținut de forțele van der Waals în potențialul de sondă, face oscilații termice normale la suprafață. vibrații termice într-o direcție normală la suprafața moleculelor comise în potențialul de bine duce la faptul că cel mai energic dintre ele părăsesc suprafața. timpul mediu # 964; unei molecule de viață adsorbiți depinde de energia de adsorbție fizică. Acesta este determinat de raportul obținut pentru difuzia sare a particulelor într-o latice periodică este:
Aici, ordinea moleculelor apropiate de perioada de oscilație în potențialul bine definit de elasticitatea legăturii sale cu suprafața. Deoarece aproximativ aceeași pentru diferite perechi de elasticitate comunicare adsorbție, se crede
10 -13 secunde. Căldura de adsorbție fizică este de obicei mai mică de 10 kcal / mol, în timp ce valoarea. calculat cu formula, la temperatura camerei, se măsoară în microsecunde, în scădere cu creșterea temperaturii.
Durata de viață a moleculelor adsorbite este unul dintre parametrii principali care determină constanta de timp a procesului de adsorbție fizică. O caracteristică cantitativă a procesului este gradul de umplere al centrelor de adsorbție, definite ca # 952; (t) = Na (t) / SNT. în care Na (t) - concentrația utilizată centrelor de adsorbție (de exemplu, moleculele adsorbite ..) la momentul t, o Nopti - numărul total de locuri de adsorbție pe unitatea de suprafață. Adsorbția nu este întreaga suprafață solidă, dar numai la centrele de activ.
Fizice începe și se termină procesul de adsorbție sorbție numai pentru gazele inerte, moleculele din care au o configurație completă de electroni, poate avea loc numai la suprafață prin forțe intermoleculare ale Van der Waals. Molecule de alte gaze și vapori metalici, cu etapa de adsorbție fizică, capabile în continuare o interacțiune mai puternică cu suprafața de către forțele naturii chimice și tipul de legături covalente heteropolare. Deoarece o astfel de comunicare este posibilă numai la nivel atomic, molecula de pre-fizic adsorbit disociază în atomi, care asigură o interacțiune interatomică care sta la baza procesului chemisorption.
Diagrama de energie pentru procesul de sorbție care implică adsorbția fizică și chemisorption ca etape succesive, este prezentată în figura 4. punctată Curba 1 descrie procesul de adsorbție fizică și curba 2 - procesul de adsorbție chimică a doi atomi produși de disociere a moleculei părinte.
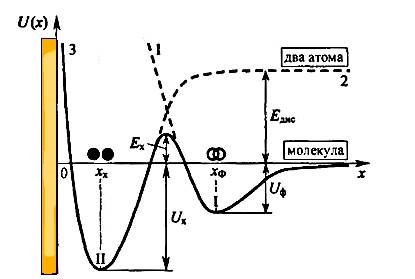
Fig. 4. Diagrama energetică pentru fazele succesive de adsorbție fizică și chimică a moleculelor diatomice pe o suprafață solidă
Curba solidă descrie 3 proces rezultantă adsorbție moleculă urmează. Se apropie molecula de suprafață adsorbit fizic spontan, adică. E. Rolls în potențial adâncime bine I Uf și situat la o distanță de suprafața kph. trecerea ulterioară a unei astfel de molecule în chemisorption potențială adâncime de bine Ux II ca doi atomi situate la distanța x. Este nevoie de depășirea potențialului înălțimea barierei Ex, care separă groapa I și II. Acest lucru poate doar molecule având conținut de suficientă energie ce depășește energia de disociere Edis. Înălțimea Ex Chemisorpția a barierei potențial este numită energia de activare a procesului de chemiosorpție. În acest sens, chemisorption, cum ar fi de difuzie este proces activat termic. Prin urmare, acesta este adesea numit adsorbție activat.
Deoarece forța interatomică este de 5-10 ori mai mare decât Van der Waals forța, căldură Qx = Ux NA adsorbție chimică ajunge la 40-100 kcal / mol. Aceasta asigură o durată de viață de particule în stare adsorbită, măsurată în ore, zile sau chiar ani, în funcție de temperatura.
Diagrama energetică ne permite să dea, confirmată prin experiment, o explicație a dependența de temperatură a gradului de umplere a siturilor de adsorbție staționare # 952; 0 este prezentată calitativ în Fig. 5, care urmează.
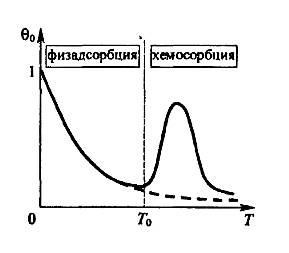
Fig. 5. Dependența de temperatură a gradului de umplere a siturilor de adsorbție staționare
La temperaturi scăzute, energia vibrațiilor termice ale moleculelor adsorbite fizic este insuficient pentru separarea lor de suprafață. Rezultatul este o adsorbție monostrat, cu un grad de umplere # 952; 0 este aproape de unitate. Odată cu creșterea temperaturii cantității # 952; 0 scăderi datorate creșterii moleculelor de ejecție verosimilitate înspre exterior față de potențial I (a se vedea figura 4 ..). Deoarece temperatura de creștere este eficientă concurente molecula proces umklapp (sub formă de doi atomi) prin bariera de activare in gaura Ex II. Prin urmare, la proces suficient de mare de conversie a temperaturii moleculelor adsorbite fizic adsorbit chimic atomi în devine dominantă asupra eliberării de căldură de proces la exteriorul primului de potențial I. Acest lucru explică ascensiunea pornind de la o temperatură T0 în Fig. 5. Cu toate acestea, la temperaturi mai ridicate au energie atomi adsorbit chimic atât de mare a vibrațiilor termice care sunt emise spre exteriorul potențial adâncimea bine II (Ux + Ex) și unei molecule de îmbinare se evaporă de la suprafață. Ca rezultat, există chemisorption maximă a curbei (Figura 4). Natura face ca procesul de chemisorption activat termic, spre deosebire de adsorbție fizică ireversibilă: modificarea temperaturii de la T1 la T2, apoi se întoarce la pornire temperatura T1 lasă neschimbat cantitatea de gaz adsorbit.