Mai precis, dependența vitezei de reacție constantă la temperatură este descrisă de ecuația Arrhenius:
,
Dacă temperatura este concentrație variată de reactanți rămâne constantă, dependența vitezei de reacție la temperatură este descrisă de ecuația:
- baza logaritmului natural;
- reacția de energie de activare, J / mol;
- gaz universal constant J / mol · K;
Energia de activare - energia suplimentară sau un exces minim în comparație cu energia medie a speciilor reactive, care trebuie să aibă particulele care se ciocnesc pentru a reacționa. Particulele care au o astfel de energie sunt numite active. Energia de activare a procesului depinde de natura reactanților. Valorile energiilor de activare pentru reacțiile pot cuprinsă între 40 și 200 kJ / mol.
Energia de activare (Ea) arată ce energie minimă (per 1 mol) al particulelor trebuie să aibă, astfel încât acestea să poată reacționa.
- în cazul în care Ea <40 кДж/моль, то значительная часть столкновений молекул приводит к реакции и скорость велика.
-dacă 40 <Еа <120 кДж/моль скорость удобно меняется.
-dacă Ea> 180 kJ / mol. reacția se produce foarte lent.
Concentrarea diagramei energetice arată Arrhenius
Revers reacție endotermă:
H2 (T) + J2 (r) 2HJ; # 8710; H 0 p (T) = 54 kJ.
distribuție Maxwell - Boltzmann:
În condiții normale, doar o parte din moleculele au suficientă energie pentru a depăși pragul. Deoarece temperatura de astfel de molecule devin mai mult și crește viteza de reacție. Este cunoscut faptul că moleculele de gaz la o temperatură dată, au o energie cinetică diferită descrisă prin distribuția Maxwell-Boltzmann |:
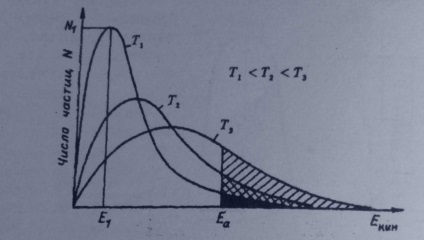
Graficele de distribuție a energiei pentru diferite temperaturi ale particulelor arată că, odată cu creșterea temperaturii, numărul de astfel de molecule crește. Mai precis dependența constantă de temperatura vitezei de reacție chimică este descrisă de ecuația.
Din ecuația Arrhenius că, atunci când k = k0 Ea = 0. Se poate presupune că, în aceste condiții, fiecare coliziune de particule conduce la o reacție chimică. Teoria cinetică a gazelor permite calcularea numărului de coliziuni de particule pe unitatea de timp (z). Experiența arată că nu fiecare întâlni chiar și molecule active conduce la o reacție. Avem nevoie de o condiție mai multe din fluxul de reacție - orientarea moleculară definită favorizează redistribuirea a densității de electroni. Prin urmare, factorul de k0 pre-exponențială include factorul de orientare moleculară (factor de probabilitate) Rohr:
Factorul de probabilitate scade odată cu creșterea numărului și complexității speciilor reactive de la o actiune la 10-9.
Astfel, factorul de pre-exponențială reflectă frecvența de coliziune și orientarea particulelor reactive.
Diagrama energetică a reacțiilor chimice:
Diagrama energetică pentru produsul de reacție formarea AB din materii prime A și B. Dacă energia de coliziune a moleculelor A și B este mai mare sau egală cu EA energie de activare. Acesta depaseste bariera de energie, iar mișcarea are loc de-a lungul coordonatei r din reacția materiilor prime la un produs. În caz contrar, există o coliziune elastică a moleculelor A și B. Partea superioară a barierei de energie corespunde stării de tranziție (complex activat), în care leagă A-B este formată parțial.
6. complex activat, proprietățile sale. (Exemplu)
Reacția începe numai între particule, care au mare de energie. Astfel de particule se ciocnesc cu primul așa-numita formă activat complex (AK). Apoi complex activat“este descompus pentru a forma produse de reacție. Educația AK energetic mai favorabil decât prăbușirea tuturor moleculelor în atomi, și apoi formarea de noi legături. Proprietățile AK:,
1) AA nu este compus chimic.
2) AK are un timp foarte scurt.
3) Pentru o reacție reversibilă a AK este aceeași pentru directă și
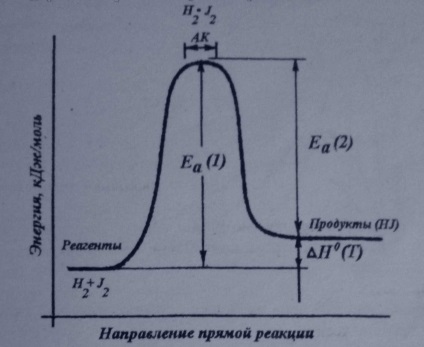
4) reacția de formare este puterea Ea AC.
Reacția H2 + J2 activat complex este un dimer plat H2 * J2v în care toate referințele sunt alungite în comparație cu moleculele de materii prime. În reacții reversibile, energia de activare este diferită pentru înainte și reacții inverse. Diferența dintre energiile de activare ale înainte și reacții inverse este entalpia de reacție (H0 (T)), particule cu energie mai mare sau egală cu Ea numită activă.